Asymetryczna dihydroksylacja Sharplessa
Asymetryczna dihydroksylacja Sharplessa – reakcja chemiczna olefin z tetratlenkiem osmu (OsO4) w obecności chiralnego ligandu chininowego, której produktami są wicynalne diole[1][2][3].

RL = Największy podstawnik; RM = Średni podstawnik; RS = Najmniejszy podstawnik
Źródłem tetratlenku osmu jest osmian(VI) potasu.
Aby ograniczyć ilość drogiego i bardzo toksycznego tetratlenku osmu w celu przeprowadzenia reakcji dodaje się także heksacyjanożelazian(III) potasu[4][5] lub N-tlenek N-metylomorfoliny[6][7], które regenerują zużyty katalizator.

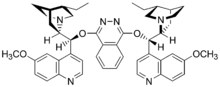
Mieszanina wyżej wymienionych reagentów jest dostępna komercyjnie pod nazwą AD-mix. Jeśli chiralnym ligandem jest (DHQ)2-PHAL jest to AD-mix-α, natomiast dla (DHQD)2-PHAL jest to AD-mix-β[8].
Reakcję tę odkrył w 1988 roku Barry Sharpless, bazując na znanej wcześniej racemicznej dihydroksylacji Upjohna. Za to odkrycie otrzymał w 2001 roku Nagrodę Nobla w dziedzinie chemii.
Mechanizm reakcji edytuj
W pierwszym etapie reakcji powstaje kompleks tetratlenek osmu - ligand (2). Ulega on cykloaddycji [3+2] z alkenem (3), tworząc cykliczną pochodną (4)[9][10], która ulega hydrolizie uwalniając wicynalny diol (5) - produkt reakcji oraz zredukowany osmian (6). Stechiometryczny dodatek heksacyjanożelazianu(III) potasu regeneruje kompleks (2) zamykając tym samym cykl katalityczny.
Przeprowadzając reakcję bez chiralnego ligandu zachodzi konieczność użycia stechiometrycznej ilości tetratlenku osmu. Zastosowanie katalitycznego cyklu tysiąckrotnie zmniejsza koszty i umożliwia bezpieczną do przeprowadzenia syntezę.
Dihydroksylację Sharplessa można przeprowadzić z wysoką enencjoselektywnością niezależnie od zestawu podstawników w użytym alkenie. Reakcja jest też selektywna wobec pozycji wiązania podwójnego w polienach, preferując dihydroksylowanie wiązania bardziej bogatego w elektrony[11].
Zastosowanie edytuj
W przykładowej reakcji dihydroksylacja Sharplessa umożliwia syntezę azacukru (6)[12].
Cały proces syntezy odbywa się bez udziału grup ochronnych w środowisku wodnym.
Zobacz też edytuj
Przypisy edytuj
- ↑ E. N. Jacobsen, I. Marko, W. S. Mungall, G. Schroeder i inni. Asymmetric dihydroxylation via ligand-accelerated catalysis. „J. Am. Chem. Soc.”. 110, s. 4685–4696, 1968. DOI: 10.1021/ja00214a053.
- ↑ C. H. Kolb, M. S. VanNieuwenhze, K. Barry Sharpless. Catalytic Asymmetric Dihydroxylation. „Chem. Rev.”. 94, s. 2483-2547, 1994. DOI: 10.1021/cr00032a009.
- ↑ J. Gonzalez, C. Aurigemma, L. Truesdale. SYNTHESIS OF (+)-(1S,2R)- AND (−)-(1R,2S)-trans-2-PHENYLCYCLOHEXANOL VIA SHARPLESS ASYMMETRIC DIHYDROXYLATION (AD). „Org. Syn.”. 79, s. 93, 2002.
- ↑ M. Minato, K. Yamamoto, J. Tsuji. Osmium tetraoxide catalyzed vicinal hydroxylation of higher olefins by using hexacyanoferrate(III) ion as a cooxidant. „J. Org. Chem.”. 55 (2), s. 766-768, 1990. DOI: 10.1021/jo00289a066.
- ↑ Ryu Oi, K. Barry Sharpless. 3-[(1S)-1,2-DIHYDROXYETHYL]-1,5-DIHYDRO-3H-2,4-BENZODIOXEPINE. „Org. Syn.”. 73, s. 1, 1996.
- ↑ V. VanRheenen, R. C. Kelly, D. Y. Cha. An improved catalytic OsO4 oxidation of olefins to -1,2-glycols using tertiary amine oxides as the oxidant. „Tetrahedron Lett.”. 17 (23), s. 1973-1976, 1976. DOI: 10.1016/S0040-4039(00)78093-2.
- ↑ B. H. McKee, D. G. Gilheany, K. Barry Sharpless. (R,R)-1,2-DIPHENYL-1,2-ETHANEDIOL (STILBENE DIOL). „Org. Syn.”. 47 (70), s. 1, 1992.
- ↑ K. Barry Sharpless i inni, The osmium-catalyzed asymmetric dihydroxylation: a new ligand class and a process improvement, „J. Org. Chem.”, 10, 57, 1992, s. 2768–2771, DOI: 10.1021/jo00036a003.
- ↑ E. J. Corey, Mark C. Noe, Michael J. Grogan. Experimental test of the [3+2]- and [2+2]-cycloaddition pathways for the bis-cinchona alkaloid-OsO4 catalyzed dihydroxylation of olefins by means of 12C/13C kinetic isotope effects. „Tetrahedron Letters”. 37 (28), s. 4899-4902, 1996. DOI: 10.1016/0040-4039(96)01005-2.
- ↑ Albert J. DelMonte i inni, Experimental and Theoretical Kinetic Isotope Effects for Asymmetric Dihydroxylation. Evidence Supporting a Rate-Limiting “(3 + 2)” Cycloaddition, „J. Am. Chem. Soc.”, 41, 119, 1997, s. 9907–9908, DOI: 10.1021/ja971650e.
- ↑ Mark C. Noe, Michael A. Letavic, Sheri L. Snow. Asymmetric Dihydroxylation of Alkenes. „Organic Reactions”. 66, s. 109, 2005. DOI: 10.1002/0471264180.or066.02.
- ↑ Ulf M. Lindström, Rui Ding, Olle Hidestål. Efficient asymmetric synthesis of an azasugar in water. „Chem. Commun.”. 66, s. 1773-1774, 2005. DOI: 10.1039/b500190k.