Helicobacter pylori
Helicobacter pylori (w skrócie Hp, dawna nazwa Campylobacter pylori) – Gram-ujemna, wyposażona w kilka witek bakteria o helikalnym kształcie, która zaliczana jest do pałeczek. Bakteria ta zasiedla powierzchnię komórek nabłonkowych błony śluzowej części przedodźwiernikowej żołądka.
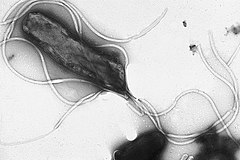 Helicobacter pylori w obrazie z mikroskopu elektronowego | |
| Systematyka | |
| Domena | |
|---|---|
| Typ | |
| Klasa | |
| Rząd | |
| Rodzina | |
| Rodzaj | |
| Gatunek |
H. pylori |
| Nazwa systematyczna | |
| Helicobacter pylori (Marshall et al., 1985) Goodwin et al., 1989 | |
Światowa Organizacja Zdrowia w 2006 r. szacowała, że zainfekowanych tą bakterią było ok. 70% ludzi w krajach rozwijających się i ok. 30% w krajach rozwiniętych[1]. Jej obecność zwiększa ryzyko wystąpienia takich schorzeń jak zapalenie żołądka typu B (mogące prowadzić do powstania nowotworu) i wrzody trawienne. Obecnie wiadomo, że H. pylori odpowiada w przybliżeniu za 80% przypadków choroby wrzodowej żołądka i 90% przypadków choroby wrzodowej dwunastnicy. Jednakże u większości zakażonych osób choroba nie rozwija się; wysunięto wiele hipotez wyjaśniających ten fakt, ale żadna z nich nie uzyskała powszechnej aprobaty. Uważa się, że helikalny kształt bakterii (od którego wzięła się nazwa rodzaju) ma jej ułatwiać ruch w warstwie śluzu[2][3][4].
Historia odkrycia edytuj
Bakterie Helicobacter pylori zostały odkryte przez niemieckich naukowców w 1875, ale nie udało im się ich sztucznie wyhodować w laboratorium i szybko o nich zapomniano[5]. W 1893 włoski badacz Giulio Bizzozero opisał bakterie helikalnego kształtu żyjące w kwaśnym środowisku żołądka psa[6]. Po raz drugi, niezależnie od badania z 1875, bakterie te zostały zauważone przez Walerego Jaworskiego pracującego na Uniwersytecie Jagiellońskim w 1899. Zaobserwował on charakterystyczne spirale bakterii i nazwał je Vibrio rugula. Jako pierwszy zasugerował także, że mogą one powodować schorzenia żołądka, ale swoje obserwacje opublikował jedynie po polsku, w książce „Podręcznik chorób żołądka i dietetyki szczegółowej”[7] i przeszły one niezauważone. W 1952 r. Kornberg opisał hydrolizę znakowanego węglem C-14 mocznika w żołądku kota[8]. Zauważył również, że zjawisko to jest hamowane po podaniu antybiotyków[8]. Obecnie wiadomo, że przyczyną rozkładu mocznika jest wydzielanie ureazy przez bakterie Helicobacter, a oparty na podobnej zasadzie test jest wykorzystywany od 1987 roku w diagnostyce zakażeń. W 1982, kiedy po raz pierwszy udało się wyhodować drobnoustrój, zauważono jego ogromne podobieństwo morfologiczne do rodziny Campylobacter, naukowcy nazwali więc wykryte bakterie organizmami podobnymi do Campylobacter (ang. CLO – Campylobacter-like organisms)[9]. Różnica dotyczyła jedynie licznych rzęsek, które w rodzinie Campylobacter są niezmierną rzadkością[9]. Początkową nazwą było Campylobacter pyloridis (1984), zamienione w 1987 na Campylobacter pylori[10]. Po zbadaniu genomu w 1989 szczepy zakwalifikowano ostatecznie do rodzaju Helicobacter[10]. Początkowo nie było pewne, czy bakteria ma jakiekolwiek szkodliwe działanie. Aby to udowodnić, ochotnicy wypili zawiesinę zawierającą hodowlę bakterii[11][12]. Wystąpiły u nich objawy ostrego zapalenia żołądka, co było ważnym dowodem na chorobotwórcze działanie H. pylori[11][12]. Odkrycie jest przypisywane dwóm australijskim patologom z uniwersytetu w Perth, Barry'emu Marshallowi i Robinowi Warrenowi, którzy za to odkrycie zostali w 2005 uhonorowani Nagrodą Nobla w dziedzinie medycyny[13].
Stosunkowo szybko dostrzeżono powiązanie pomiędzy wrzodami i zapaleniem żołądka a obecnością bakterii w żołądku[14]. Helicobacter pylori jest najważniejszą bakterią wśród flory żołądkowej człowieka. Odkryto również inne gatunki z rodzaju Helicobacter u ssaków i ptaków; niektóre z nich także mogą zakażać ludzi[15]. Odkryto również, że niektóre gatunki z rodzaju Helicobacter zakażają wątroby pewnych ssaków, co prowadzi do chorób[16].
Niedawne badania wskazują, że różnorodność genetyczna H. pylori zmniejsza się wraz z odległością od Afryki Wschodniej, miejsca pochodzenia współczesnych ludzi. Przy pomocy danych o różnorodności genetycznej badacze stworzyli symulacje, które wskazują, że bakterie rozprzestrzeniły się z Afryki Wschodniej około 58000 lat temu. Wyniki wskazują, że zakażenie H. pylori u nowoczesnych ludzi występowało przed rozpoczęciem migracji z Afryki[17].
Biologia edytuj
Od czasu zaklasyfikowania bakterii jako Helicobacter pylori odkryto dziesiątki innych gatunków z rodzaju Helicobacter, które bytują w przewodzie pokarmowym różnych zwierząt.
Morfologia i fizjologia edytuj
Bakterie H. pylori są podobne pod względem morfologicznym do bakterii Campylobacter, jednakże są od nich zazwyczaj większe. Długość bakterii wynosi 3–6 μm, a szerokość 0,6 μm. Drobnoustrój nie wytwarza przetrwalników.
Bakteria bytuje w warunkach niewielkiej dostępności tlenu na powierzchni błony śluzowej żołądka i dwunastnicy, rzadziej na błonie wyścielającej przełyk, wykazując dużą ruchliwość w śluzie pokrywającym błony. Ruchliwość ta wynika z faktu posiadania przez bakterię kilku, zazwyczaj do sześciu, pojedynczych witek. Nie ma jednomyślności w sprawie prawidłowej kwalifikacji bakterii pod względem wymagań tlenowych – jest ona zaliczana do mikroaerofilów albo do beztlenowców[18]. Te rozbieżności prowadzą do różnic w warunkach hodowlanych stosowanych przez laboratoria mikrobiologiczne w celu zapewnienia bakteriom optymalnego środowiska do wzrostu[18]. Badania dowiodły, że duże kolonie są w stanie wzrastać w szerokim zakresie stężeń tlenu[18]. Helicobacter pylori wytwarza hydrogenazę, dzięki której może pozyskiwać energię z utlenienia cząsteczkowego wodoru (H2) wytwarzanego przez inne bakterie jelitowe[19]. Może wytwarzać biofilmy[20], a także przechodzić z formy spiralnej do postaci ziarenkowca[21], co prawdopodobnie ułatwia jej przeżycie i rozprzestrzenianie się. Forma ziarenkowca nie została wyhodowana, ale odkryto ją w sieci wodociągowej w Stanach Zjednoczonych. Odkryto również, że ta forma może przylegać do komórek nabłonkowych żołądka in vitro.
Helicobacter pylori jest raczej wrażliwy na warunki zewnętrzne, potrafi jednak przeżywać w kwaśnym środowisku[22]. Bakteria posiada pięć głównych rodzin białek błony zewnętrznej (OMP)[23]. Największa rodzina zawiera znane i domniemane adhezyny. Pozostałe cztery rodziny zawierają poryny, transportery żelaza, białka związane z rzęskami i białka o nieznanej funkcji. Podobnie jak inne typowe Gram-ujemne bakterie, błona zewnętrzna H. pylori składa się z fosfolipidów i lipopolisacharydu (LPS). Antygen O lipopolisacharydu może podlegać fukozylacji i przypominać antygeny grupowe krwi Lewisa znajdujące się na nabłonku żołądkowym[23]. Zewnętrzna błona zawiera też glukozydy cholesterolu, który występuje u niewielkiej liczby innych bakterii[23].
| Cecha | Wynik | Cecha | Wynik |
|---|---|---|---|
| Ureaza | wytwarza | Katalaza | wytwarza |
| Oksydaza | wytwarza | Produkcja H2S | brak |
| Redukcja azotanów | brak | Hydrolaza hipuranu | brak |
| Fosfataza zasadowa | wytwarza | Aminopeptydaza argininowa | wytwarza |
| γ-glutamylo-transferaza | wytwarza | Aminopeptydaza histydynowa | wytwarza |
Cechy biochemiczne mogą służyć do różnicowania bakterii w obrębie rodzaju. Zdolność do wytwarzania ureazy jest wykorzystywana w diagnostyce.
Czynniki wirulencji edytuj
Czynniki wirulencji są to takie cechy bakterii, które pozwalają jej przełamywać naturalne systemy obronne organizmu. Treść żołądkowa ma odczyn kwaśny i posiada wyjątkowo niskie pH, wynoszące 2–4, które jest zabójcze dla większości bakterii. Cechy umożliwiające przeżycie w tym wybitnie trudnym środowisku to[25]:
- Wytwarzanie w dużych ilościach ureazy – enzymu katalizującego rozkład mocznika do amoniaku i dwutlenku węgla. Amoniak powoduje neutralizację kwasu solnego obecnego w soku żołądkowym i podwyższenie pH w bezpośrednim otoczeniu bakterii. Najmniejsze pH, przy którym obserwowany jest jeszcze wzrost bakterii in vitro wynosi 4,5; jeżeli jednak do podłoża zostanie dodany mocz (zawierający mocznik) wzrost jest widoczny nawet przy pH 3,5[22].
- Rzęski – sześć rozmieszczonych biegunowo rzęsek umożliwia poruszanie się i wnikanie pod warstwę śluzową. Warstwa śluzowa chroni komórki żołądka przed działaniem kwasu solnego; w ten sposób bakteria korzysta z ochronnego systemu gospodarza. Dzięki nim bakteria jest bardzo ruchliwa[26]. Charakterystyczne włókna rzęsek pokryte osłonką składają się z dwóch współpolimeryzowanych flagelin: FlaA i FlaB[27].
- Pompa wypompowująca jony H+ z komórek. Blokowanie tych pomp przez niektóre leki (np. omeprazol) podnosi pH w żołądku, który jest środowiskiem życia drobnoustroju[28].
- Układ antyoksydacyjny mający na celu neutralizację wolnych rodników wytwarzanych przez neutrofile. Jest on dość złożony, w jego skład wchodzą enzymy katalaza, dysmutaza ponadtlenkowa, niedawno odkryte antyoksydacyjne białka MdaB oraz NapA (Neutrophil-activating protein)[29] oraz bardzo sprawny system naprawiający uszkodzenia DNA[30].
- Adhezyny odpowiadające za przyleganie do nabłonka żołądka.
- Cytotoksyny – kodowane w genach vacA (50% szczepów) i cagA (70% szczepów). Toksyna wakuolizująca (vacA) powoduje w komórkach nabłonkowych zlanie endosomów z lizosomami i sprzyja tworzeniu ogromnych wakuoli[31]. Ułatwia ponadto swobodny przepływ mocznika do światła żołądka[32]. Toksyna cytotoksyczna zaburza cytoszkielet komórek nabłonkowych i zwiększa adhezję bakterii do tak uszkodzonego nabłonka.
Epidemiologia edytuj
Zakażenie H. pylori występuje powszechnie na całym świecie, chociaż stwierdza się różnice w częstości infekcji w poszczególnych krajach. Regułą jest, że częściej zakażenia tą bakterią stwierdza się w krajach rozwijających się, gdzie dotyka co najmniej 70% osób, a tylko u ok. 30% populacji w krajach wysokorozwiniętych[1][33]. Ocenia się, że w Polsce zakażonych jest ok. 84% osób dorosłych i ok. 32% osób do 18. roku życia[34].
Drogi zakażenia edytuj
Zakażenie bakterią następuje na drodze pokarmowej, najczęściej we wczesnym dzieciństwie przed osiągnięciem 10 roku życia[1] i od tego czasu utrzymuje się przez całe życie, chociaż potwierdzono, że u części dzieci może dochodzić do samoistnego ustąpienia zakażenia[35][36]. Uważa się, że do transmisji infekcji dochodzi z człowieka na człowieka i ustalono, że najczęściej matka zakaża dziecko.
Istnieje wiele wątpliwości co do drogi, poprzez którą najczęściej dochodzi do zakażenia[37][38]. Rozważane są: gastro-oralna, oralno-oralna i fekalno-oralna. Często do infekcji może dochodzić w wyniku kontaktu ze śliną zainfekowanej osoby (picie ze wspólnych butelek, jedzenie ze wspólnego talerza) lub poprzez jedzenie zanieczyszczonymi rękami. Istnieje również możliwość przeniesienia zakażenia drogą kontaktu oralno-analnego[39].
Chorobotwórczość edytuj
1. H. pylori penetruje warstwę śluzową żołądka gospodarza i przylega do powierzchni komórek epitelialnych śluzówki żołądka.
2. Przy pomocy ureazy produkuje z mocznika amoniak, który neutralizuje kwas żołądkowy, co pozwala jej na przeżycie.
3. Namnaża się, migruje i tworzy miejsce zakażenia.
4. W wyniku zniszczenia śluzówki, procesu zapalnego i martwicy komórek śluzówki dochodzi do powstania owrzodzenia żołądkowego.
W swoich badaniach Barry Marshall i Robin Warren udowodnili, że choroba wrzodowa jest chorobą zakaźną, w której bakteria jest podstawowym czynnikiem patogenetycznym. Ponadto wykazali związek zakażenia z kilkoma chorobami górnego odcinka przewodu pokarmowego, ale samo zakażenie H. pylori nie daje objawów patognomonicznych[40].
Zapalenie błony śluzowej żołądka edytuj
Po dostaniu się do żołądka bakterie H. pylori wywołują fazę ostrą zapalenia z uszkodzeniem nabłonka błony śluzowej, zmniejszoną produkcją śluzu oraz zmniejszeniem wydzielania kwasu solnego (hipochlorhydria). Uszkodzenie komórek nabłonka powodują związki produkowane przez H. pylori: amoniak, proteazy, cytotoksyna A, i niektóre fosfolipazy[41]. Rzadko (głównie u dzieci) może dojść do zwalczenia zakażenia i samowyleczenia, ale częściej dochodzi do przewlekłej fazy zakażenia. Zakażenie H. pylori jest najczęstszą przyczyną przewlekłego zapalenia błony śluzowej żołądka.
Zakażenie wywołuje zmiany w błonie śluzowej żołądka – zapalenie błony śluzowej typu B. W ok. 80% przypadków nie ma wyraźnych objawów choroby, a poziomy gastryny oraz wydzielanie kwasu solnego przez błonę śluzową żołądka są prawidłowe. Dwa szczególne typy zapalenia są związane z występowaniem chorób. W ok. 15% przypadków u ludzi produkujących duże ilości kwasu solnego dochodzi do zmian zapalnych w okolicy przedodźwiernikowej żołądka (antrum gastritis), które powodują zwiększenie wydzielania gastryny[42] i kwasu solnego (którego wydzielanie jest dodatkowo wzmagane przez gastrynę[43]), a co za tym idzie zagrożenie wystąpieniem owrzodzenia żołądka lub dwunastnicy. Kolonizacja okolicy wpustu jest korzystna dla H. pylori ze względu na pewne oddalenie od komórek okładzinowych trzonu żołądka, które produkują kwas solny[23] . W pozostałych ok. 5% przypadków powoduje zmiany zapalne w błonie śluzowej żołądka, które zlokalizowane są przede wszystkim w trzonie i dnie żołądka (pangastritis), a poziom gastryny jest zwiększony, natomiast stwierdza się hipochlorhydrię – ten typ zapalenia powiązany jest ze zwiększonym ryzykiem wystąpienia raka żołądka.
Przewlekłe zapalenie błony śluzowej związane z zakażeniem H. pylori powoduje atrofię błony śluzowej i pojawianie się ognisk metaplazji jelitowej.
Choroba wrzodowa edytuj
Istnieje silny związek między zakażeniem H. pylori, a występowaniem choroby wrzodowej dwunastnicy. U zdecydowanej większości chorych stwierdza się to zakażenie (80-95%), a pozostałe przypadki wiążą się np. z przewlekłym zażywaniem niesteroidowych leków przeciwzapalnych lub hipergastrynemią z innych przyczyn. Eradykacja drobnoustroju doprowadza do wyleczenia i zapobiega nawrotom choroby. U podłoża powstawania owrzodzeń dwunastnicy może leżeć kilka mechanizmów, zależnych od infekcji H. pylori:
- zwiększone wytwarzanie kwaśnego soku żołądkowego
- powstawanie ognisk metaplazji żołądkowej
- rozwój miejscowej reakcji zapalnej błony śluzowej
- osłabienie procesów obronnych błony śluzowej
U pacjentów z zakażeniem H. pylori stwierdza się zwiększone stężenie gastryny we krwi[44][45], zarówno podstawowe jak i po stymulacji oraz zmniejszone stężenie somatostatyny[46]. Zależność pomiędzy występowaniem wrzodów a infekcją jest mniejsza u pacjentów z marskością wątroby[47].
Rak żołądka edytuj
Główne typy morfologiczne raka żołądka to typ jelitowy i typ rozlany[48]. Przewlekła infekcja Helicobacter pylori ma dobrze udokumentowany wpływ na rozwój typu jelitowego, nie wpływając na drugi rodzaj morfologiczny raka[48]. Rozbieżności w częstości występowania raka w różnych rejonach geograficznych mogą być tłumaczone innym genomem bakterii w różnych rejonach, nie wszystkie szczepy są tak samo wirulentne (w zależności od obecności genów vacA i cagA)[49].
Dostrzeżono korelację pomiędzy obecnością bakterii a występowaniem wczesnego raka żołądka[50].
Chłoniak MALT edytuj
Długotrwała stymulacja układu immunologicznego w przebiegu infekcji Helicobacter pylori skutkuje ryzykiem rozwoju chłoniaków błony śluzowej żołądka[51]. Z przeprowadzonych badań wynika, że bakteria ma wpływ na rozwój około 90% chłoniaków MALT (mucosa associated lymphatic tissue – nowotwór tkanki limfatycznej przewodu pokarmowego) żołądka[52], który jest najczęstszą lokalizacją tych nowotworów w całym przewodzie pokarmowym[48]. Ryzyko rozwoju nowotworu jest większe, jeśli w genomie bakterii znajduje się gen vacA[53]. Po eradykacji bakterii chłoniak ulega często regresji, o ile powstał na tle przewlekłej infekcji drobnoustrojem[54].
Wpływ na inne choroby edytuj
Zakażenie Helicobacter pylori powiązano w badaniach z wieloma chorobami spoza przewodu pokarmowego, takimi jak astma, przewlekła obturacyjna choroba płuc, rozstrzenie oskrzeli, choroba niedokrwienna serca, udar mózgu, choroba Raynauda, pierwotny ból głowy, zespół Sjögrena, zapalenie naczyń związane z IgA, autoimmunologiczna małopłytkowość, autoimmunologiczne zapalenie tarczycy, choroba Parkinsona, idiopatyczna chroniczna pokrzywka, trądzik różowaty[55], łysienie plackowate, opóźnianie wzrastania, marskość wątroby, ale nie są to dane przekonujące. Jedynymi stanami, w których należy zastosować eradykację to niedokrwistości z niedoboru żelaza o niewyjaśnionej etiologii oraz przewlekła idiopatyczna małopłytkowość samoistna[56][57].
Nie udowodniono, aby u dzieci bez choroby wrzodowej i przewlekłego zapalenia błony śluzowej żołądka i dwunastnicy eradykacja Helicobacter pylori mogła spowodować ustąpienie bólów brzucha, ani nie wykazano związku pomiędzy zakażeniem Helicobacter pylori a bólami brzucha[40][56]. Istnieje hipoteza, iż zakażenie bakterią ma niewielki wpływ na powstanie raka jelita grubego[58][59]. Dowiedziono, że infekcja wybitnie zmniejsza ryzyko wystąpienia podtypu gruczołowego raka przełyku oraz przełyku Barretta, nie ma jednak żadnego wpływu na rozwój raka płaskonabłonkowego[60][61]. Wydaje się, że szczególnie ochronnie działają szczepy posiadające gen cagA[62][63].
W przypadku obecności bakterii w wątrobie, zwiększone jest ryzyko powstania raka wątrobowokomórkowego[64][65]. Ponadto ten typ raka występuje częściej u osób zakażonych drobnoustrojem niż w grupie kontrolnej[66]. Infekcja występuje częściej u osób z wirusowym zapaleniem wątroby typu C i prawdopodobnie przyspiesza rozwój marskości w jej przebiegu[67][68]. Część badań nie potwierdza wpływu bakterii na choroby wątroby[69].
Zasugerowano wpływ Helicobacter pylori na choroby urologiczne, głównie nowotwory (duże badanie retrospektywne)[70]. Być może infekcja bakterią w dzieciństwie zapobiega rozwojowi astmy i alergii[71].
Karcynogenność edytuj
Badane są dwa powiązane mechanizmy, dzięki którym H. pylori mógłby promować rozwój raka. Jeden z nich opiera się na produkcji wolnych rodników w pobliżu H. pylori i zwiększaniu tempa zachodzenia mutacji komórek gospodarza. Drugim zaproponowanym mechanizmem jest "ścieżka perigenetyczna"[72], która polega na wzmocnieniu przekształconego fenotypu komórki gospodarza poprzez zmiany w białkach komórki takich jak białka adhezyjne. Zasugerowano, że H. pylori wywołuje zapalenie i lokalnie podniesienie poziomów TNF-α i/lub interleukiny 6. Według zaproponowanego mechanizmu perigenetycznego sygnalizacyjne czynniki zapalne, takie jak TNF-α mogą zmieniać adhezję komórek nabłonka żołądkowego i prowadzić do rozproszenia i migracji zmutowanych komórek nabłonkowych bez potrzeby dodatkowych mutacji w genach supresorowych takich jak te, które kodują białka adhezyjne[73].
Diagnostyka edytuj
Warunkiem wstępnym do rozpoczęcia leczenia jest rozpoznanie zakażenia. Diagnostyka, w zależności od konieczności wykonania endoskopii, jest dzielona na inwazyjną lub nieinwazyjną[74].
Istotne jest, że na obniżenie dokładności badania może wpływać:
- stosowanie leków z grupy inhibitorów pompy protonowej
- stosowanie leków z grupy H2-blokerów
- zażywanie antybiotyków
przed jego wykonaniem. Z tego względu konieczne jest odstawienie ww. leków na 1–2 tygodnie przed terminem planowanego badania w kierunku H. pylori.
Badania inwazyjne edytuj
Gastroskopia edytuj
2. krzywizna większa
3. trzon
4. (kolano)
5. jama odźwiernikowa
6. kanał odźwiernika
7. wcięcie kątowe
8. krzywizna mniejsza
9. fałdy żołądkowe
E. przełyk
D. dwunastnica (opuszka i fragment części zstępującej)
Badania inwazyjne polegają na wykonaniu gastroskopii z biopsją. Pobrany materiał może zostać poddany testowi na wytwarzanie ureazy, ocenie histopatologicznej lub założeniu hodowli[74]. Bakterie nie są rozmieszczone równomiernie we wszystkich częściach żołądka – praktycznie zawsze zajęta jest okolica odźwiernika (część odźwiernikowa), stamtąd są również pobierane wycinki do badań. Zajęcie części wpustowej lub dna żołądka jest rzadkością. W przypadku przyjmowania inhibitorów pompy protonowej następuje przesunięcie kolonizacji ku górze, wtedy również zajęty jest zazwyczaj trzon z dnem[75].
Najtańszą metodą o bardzo wysokiej specyficzności i czułości jest poddanie materiału z biopsji testowi na wytwarzanie ureazy[76][77]. Materiał wkładany jest do roztworu mocznika, a bakterie rozkładają go do amoniaku, co powoduje podwyższenie pH i zmianę zabarwienia. Test jest odczytywany po około kwadransie. Część autorów uważa ten sposób za bardziej czuły od badania histopatologicznego[78]. Należy dodać, że istnieją badania, choć są one w zdecydowanej mniejszości, kwestionujące skuteczność testu ureazowego i preferujące inne metody diagnostyczne[79].
Materiał może być również poddany metodzie namnożenia fragmentu DNA bakterii (metoda PCR). Technika ta jest bardzo czuła – w jednym z badań korelacja pomiędzy wynikami PCR a wynikami otrzymanymi metodą tradycyjną wyniosła 100%[80].
String test edytuj
Druga metoda, praktycznie nie stosowana w Europie, polega na połknięciu kapsułki zawieszonej na sznurku i trzymaniu jej w przewodzie pokarmowym przez kilka godzin[81]. Po wyjęciu dokonuje się posiewu na podłoże selektywne. Zalety tej metody to niższa cena badania, brak konieczności posiadania przeszkolonego personelu oraz wyższy komfort pacjenta[82], jednak jest ona mniej dokładna (81–93%)[83][a] i wymaga badania w laboratorium mikrobiologicznym, które jest kosztowne, czasochłonne i mało popularne[81]. W przypadku kapsułki nie ma sensu wykonywanie testu na wytwarzanie ureazy, ponieważ enzym może wytwarzać także flora fizjologiczna gardła i jamy ustnej (wyniki fałszywie dodatnie)[81]. Badanie może być przeprowadzone wiele kilometrów od placówki, w której wykonano test, jeśli transport do laboratorium zostanie przeprowadzony prawidłowo[85].
Badania nieinwazyjne edytuj
Testy na obecność przeciwciał edytuj
Badanie to polega na wykrywaniu w surowicy krwi przeciwciał klasy IgG przeciwko Helicobacter pylori. Jest ono niespecyficzne (swoistość około 50%) i generuje pewną pulę wyników fałszywie ujemnych[b], dlatego czasami prowadzona jest dodatkowa diagnostyka przeciwciał klasy IgA we krwi, a badanie obu klas immunoglobulin polepsza wartość diagnostyczną testu[87]. Badanie IgA, normalnie występującego w śluzówce przewodu pokarmowego, w materiale z biopsji nie ma jednak dużej wartości w rozpoznaniu infekcji[87]. Ze względu na niskie koszty diagnostyka obecności przeciwciał we krwi może być uznana za wartościową w badaniach przesiewowych na obecność bakterii w organizmie[88]. Poziom przeciwciał utrzymuje się na wysokich stężeniach także po udanym zakończeniu leczenia (około 6 miesięcy), nie może więc służyć do oceny skuteczności eradykacji[89].
Testy na wytwarzanie ureazy edytuj
Do badań nieinwazyjnych zalicza się ureazowy test oddechowy lub oparty na podobnej zasadzie test moczu, badanie śliny, krwi oraz kału. Technika ta polega na podaniu do wypicia pacjentowi roztworu mocznika znakowanego radioaktywnym izotopem, który jest rozkładany przez obecne w błonie śluzowej żołądka bakterie H. pylori według równania:
- H2N-CO-NH2 + H2O → 2 NH3 + CO2
Istnieją dwie główne metody badania obecności bakteryjnej ureazy, przy czym pierwsza jest znacznie bardziej rozpowszechniona:
- test oddechowy (ang. UBT – Urea Breath Test) – w cząsteczce mocznika znakowany jest atom węgla. Jeśli wyżej wymieniona reakcja zaszła, mocznik w żołądku ulegnie rozkładowi na znakowany radioaktywnym izotopem dwutlenek węgla oraz na amoniak. Część dwutlenku węgla będzie wydychana przez osobę badaną i będzie zawierał on znakowany węgiel (reakcja dodatnia). Brak obecności znakowanego CO2 w wydychanym powietrzu to wynik ujemny. Wynik jest otrzymywany po 15–30 minutach.
- test moczu – w cząsteczce mocznika znakowany jest atom azotu. Jeśli reakcja zaszła, mocznik w żołądku ulegnie rozkładowi na dwutlenek węgla oraz na znakowany amoniak. Amoniak przechodzi do krążenia i jest szybko wydalany przez nerki. Jeśli reakcja jest dodatnia, w moczu obecny będzie znakowany azot. Wynik jest otrzymywany po wielu godzinach.
Czułość testu oddechowego przekracza 90%, a specyficzność jest jeszcze wyższa[90][91]. Może być on z powodzeniem stosowany w ocenie skuteczności leczenia przeciwbakteryjnego[92][93][94]. Przed rozpoczęciem testu wskazane jest dokładne umycie zębów, języka i gardła, ponieważ flora fizjologiczna tam bytująca wytwarzając ureazę może generować wyniki fałszywie dodatnie (dodatni wynik testu przy braku Helicobacter pylori)[95]. W wątpliwych wypadkach można wykonać test dwukrotnie, przed i po umyciu jamy ustnej, a następnie porównać różnicę otrzymanych wyników[95].
Uważa się, że wiarygodność obu wariantów testu na wytwarzanie ureazy jest podobna[96]. Istnieje również inny wariant testu ze znakowanym węglem w moczniku – część rozłożonego znakowanego CO2 przechodzi do krwiobiegu, a znakowanego węgla poszukuje się w tej metodzie we krwi, a nie w wydychanym powietrzu[97]. Test oddechowy trwa krócej od gastroskopii z biopsją, przy podobnej skuteczności[98]. Istnieją dwie możliwości znakowania związków izotopami węgla – 14C lub 13C – z których stosuje się obecnie głównie niepromieniotwórczy 13C. Metoda z użyciem radioaktywnego 14C jest tańsza (nie wymaga tak specjalistycznego analizatora), zasugerowano jednak, że może się to odbyć kosztem mniejszego bezpieczeństwa pacjenta[24]. Napromieniowanie otrzymywane w trakcie badania jest jednak porównywalne do promieniowania naturalnego otrzymywanego przez mieszkańców USA w ciągu miesiąca[24].
Badanie metodą PCR edytuj
Technika ta polega na próbie namnożenia specyficznego dla bakterii fragmentu DNA, kodującego toksyny – cagA i vacA[99]. Zazwyczaj badana jest próbka kału, czułość testu na obecność tam DNA bakterii wynosi 50-60%[99]. Genom drobnoustroju obecny jest także w ślinie, jej analiza ma jednak małą wartość diagnostyczną – rezultat jednego z badań to 11 wyników pozytywnych na 19 osób na pewno chorych[80], czułość w innym wyniosła 25%[99]. Zaletami badania metodą PCR (kału lub śliny) jest bardzo wysoka swoistość (nie generuje wyników fałszywie dodatnich) oraz krótki czas czekania na wynik[99].
Hodowla edytuj
Zakładanie hodowli mikrobiologicznej jest niezmiernie rzadkie, w większości przypadków wykonywana jest ona w celach epidemiologicznych lub w celu ustalenia lekooporności szczepów występujących na danym rejonie. Wskazaniem do hodowli z wykonaniem antybiogramu jest co najmniej dwukrotna nieudana terapia eradykacyjna[100], choć nawet w tym wypadku posiew nie jest regułą. Większość standardowo używanych podłoży hodowlanych nie zapewnia wzrostu bakterii[101]. Pożywki, na których uzyskuje się wzrost, to między innymi agar SATFM (Serum- and Animal Tissue-Free Medium)[101], podłoża używane do hodowli Brucella z dodatkiem krwi[102], podłoża z cyklodekstryną[103], charcoal agar, Columbia agar czy podłoża wzbogacone wyciągiem z cyjanobakterii[104]. Podłoże selektywne można uzyskać poprzez dodanie antybiotyków niedziałających na Helicobacter pylori[105] lub poprzez specyficzny skład (np. CHBHP)[106]. Wzrost zaobserwowano także na wszystkich popularnych podłożach płynnych (wyjątkiem jest pożywka oparta na alfaketoglutaranie z wyciągiem z drożdży i wzbogacona surowicą), o ile zapewnione są odpowiednie warunki hodowli[107]. Podłożem transportowym może być powszechnie używany agar czekoladowy, na którym większość bakterii jest obecna po trzech dniach, a niektóre nawet po dziewięciu[108].
Do udanej hodowli wymagane jest mikroaerofilne środowisko, zawierające 10% CO2 i 95% wilgotność. Posiew jest jedyną metodą w diagnostyce Helicobacter pylori o 100% swoistości. Jednakże czułość wynosi tylko 50%, co oznacza, że w połowie przypadków nie uzyskiwano wzrostu, mimo obecności bakterii w materiale[109]. Szanse udanej hodowli maleją, jeżeli inokulum (początkowa ilość bakterii) było niskie. W przypadku dodania do hodowli H2O2, jeśli zawiera on H. pylori, powinno nastąpić intensywne pienienie spowodowane rozkładem przez układ antyoksydacyjny bakterii – patrz czynniki wirulencji; test ten jest jednak wybitnie niespecyficzny.
Preparat histopatologiczny edytuj
Najpopularniejszy sposób barwienia histopatologicznego, barwienie hematoksyliną i eozyną, nie zapewnia prawidłowej diagnostyki Helicobacter pylori. Interpretacja takiego preparatu wymaga dużego doświadczenia patologa[110]. Barwienie metodą Giemsy oraz metodą Genta, przy podobnej czułości, zapewnia znacznie lepszą specyficzność[111]. W jednym z badań dostrzeżono lekką przewagę metody Genta[112]. Inną metodą, o wysokiej specyficzności i czułości, jest CLOtest[110].
Najlepszą metodą, wykrywającą nawet małe ilości bakterii jest barwienie immunohistochemiczne[113][114]. Podczas analizy materiału należy początkowo ocenić cały preparat pod małym powiększeniem, wyszukując cech metaplazji lub anormalnego wyglądu skrawka. Bakteria, jeżeli jest obecna, lokalizuje się blisko wyściółki śluzowej żołądka, dlatego należy uważnie przejrzeć całą powierzchnię błony śluzowej. Drobnoustroje mogą być obecne zarówno w przypadku istnienia stanu zapalnego żołądka, jak i bez występowania jakichkolwiek jego cech. Ponieważ nie wszystkie obecne w żołądku bakterie to Helicobacter pylori, należy być ostrożnym z ostatecznym rozpoznaniem – najbardziej poprawnym sformułowaniem jest określenie bakterie podobne do H. pylori.
W przypadku ostrego zapalenia obecne są liczne neutrofile, jeśli staje się ono przewlekłe dostrzegalna jest ponadto atrofia, neoplazja i dysplazja komórek żołądka.
Leczenie edytuj
Celem leczenia jest całkowite usunięcie bakterii zagnieżdżonej w błonie śluzowej żołądka, co określa się mianem eradykacji. W zdecydowanej większości przypadków osób z bezobjawowym zakażeniem Helicobacter pylori nie jest ona rutynowo stosowana. W wypadku choroby wrzodowej eradykacja zapobiega nawrotom choroby i w istocie prowadzi do trwałego wyleczenia chorego[115]; regresja występuje także w przypadku chłoniaka MALT, o ile wystąpił na tle zakażenia Helicobacter pylori.
Farmakoterapia edytuj
Od samego początku zauważono, że standardowa terapia jednym antybiotykiem nie zapewniała sukcesu terapeutycznego[116], pomimo wrażliwości H. pylori in vitro na wiele antybiotyków[40]. Po raz pierwszy terapię potrójną zastosował w 1987 gastroenterolog z Sydney Thomas Borody. Osiągnięty konsensus z Maastricht (1997) uznawał za skuteczną terapię, w której stosowano kombinację trzech leków przez siedem dni: inhibitor pompy protonowej, metronidazol/tynidazol oraz amoksycylinę. Drugi konsensus – kanadyjski z 1999 wprowadził dodatkowo klarytromycynę (obok amoksycyliny i metronidazolu, stosowanych zamiennie)[117], która wykazywała najwyższą skuteczność wśród makrolidów[40]. Według drugiego konsensusu z Maastricht (2000) powinno stosować się[118]:
- Leki pierwszego rzutu (terapia potrójna): sole bizmutu/inhibitor oraz klarytromycyna i metronidazol/amoksycylina.
- Leki drugiego rzutu (terapia poczwórna): sole bizmutu[119][120], inhibitor, metronidazol, tetracyklina. Jeśli bizmut jest niedostępny, używa się wyłącznie trzech ostatnich leków.
Według trzeciego konsensusu z Maastricht można stosować sole bizmutu także podczas pierwszej próby eradykacji[56].
Terapia potrójna jest skuteczna w około 80–90% przypadków, o ile jest prowadzona wśród szczepów o wysokiej wrażliwości na antybiotyki (brak wcześniejszych prób eradykacji)[121][122]. Eradykacja przy zastosowaniu placebo wynosi 0%[123].
W terapii najczęściej stosowane są[40]:
- antybiotyki i chemioterapeutyki
- inhibitory pompy protonowej (IPP, podawane w celu podwyższenia pH soku żołądkowego, co pozwala na zwiększenie liczby dzielących się, a tym samym bardziej podatnych na działanie antybiotyków bakterii)
Problemem leczenia zakażenia H. pylori jest reinfekcja, a także wzrastająca oporność tej bakterii na standardowo stosowane leki. Szczepy w Polsce są najczęściej oporne na metronidazol lub klarytromycynę. Przyjmuje się, że leczenie powinno trwać 1–2 tygodnie[124]. Skuteczność jest większa, jeżeli czas trwania terapii trwa 10 dni (zamiast popularnego tygodnia)[125]. Szanse udanej eradykacji maleją po dwóch nieudanych próbach, świadczy to o obecności lekoopornych szczepów na stosowane antybiotyki i chemioterapeutyki[126]. Aktualnie rozważana jest możliwość wprowadzenia jako standardu terapii poczwórnej[127] lub terapii sekwencyjnej, ze względu na zmniejszającą się wrażliwość Helicobacter pylori na stosowane obecnie terapeutyki[128]. Wykazano wyższą skuteczność terapii sekwencyjnej (Włochy)[129] Terapia sekwencyjna polega na stosowaniu inhibitora pompy protonowej i amoksycyliny w dawce 1,0 przez 5 dni i następnie przez kolejne 5 dni inhibitora pompy protonowej, klarytromycyny i tynidazolu (oba w dawce 2 x 500 mg)[130].
Oporność na antybiotyki i chemioterapeutyki edytuj
Oporność na antybiotyki jest uważana za główną przyczynę niepowodzenia terapeutycznego eradykacji[131], obok kwaśnego pH żołądka inaktywującego antybiotyki. W badaniu przeprowadzonym wśród ludności zamieszkującej południowo-wschodnią Anatolię, pierwotna oporność na klarytromycynę wyniosła 16,4% (nie stosowano wcześniej terapii antybiotykowej)[131]. Po 14 dniach stosowania standardowej terapii potrójnej, wśród pacjentów u których bakteria była pierwotnie wrażliwa na ten lek, oporność na klarytromycynę wyniosła 27,2% (oporność wtórna)[131]. Nie zanotowano korelacji pomiędzy częstszym występowaniem oporności a jakimikolwiek cechami organizmu (wiek, płeć, aktywność soku żołądkowego etc.)[131]. W innym badaniu pierwotnie opornych na klarytromycynę było 3% szczepów, a na metronidazol 30%[121].
Oporność na klarytromycynę edytuj
Oporność na klarytromycynę (1998) wśród szczepów występujących w Europie jest najwyższa na południu (20%), a najniższa na północy (5%) kontynentu; średnia światowa wynosi około 10%[132]. Obecnie niska wrażliwość Helicobacter pylori na ten antybiotyk, występująca w USA, praktycznie wyklucza go z terapii empirycznej[128]. W eradykacji szczepów opornych na klarytromycynę zaproponowano zastosowanie lewofloksacynę[133][134]. Oporność na klarytromycynę wiąże się prawdopodobnie ze zbyt częstym używaniem makrolidów[132]. Wzrost zużycia leków z tej grupy w Japonii był dodatnio skorelowany ze wzrostem oporności Helicobacter pylori[135].
Oporność na nitroimidazole edytuj
Oporność na nitroimidazole, na przykład na metronidazol czy tynidazol, polega na zmniejszeniu aktywności nitroreduktazy. Ta grupa antybiotyków jest aktywna jedynie po zredukowaniu we wnętrzu komórki, dlatego zahamowanie enzymu redukującego zmniejsza efekt terapeutyczny.
Inne metody edytuj
W niektórych badaniach wykazano, że spożycie brokułów może efektywnie zahamowywać wzrost H. pylori[136] dzięki sulforafanowi będącemu jednym z aktywnych związków[137]. Wykazano, że guma mastyksowa zabija H. pylori in vitro[138][139], jednakże badania przeprowadzone in vivo nie wykazały takiego działania[140][141][142]. Trwają prace nad opracowaniem szczepionki przeciw zakażeniu H. pylori. Zastosowanie jej przyniosłoby możliwość profilaktyki zachorowań zarówno na chorobę wrzodową jak i raka żołądka.
Badania genomu różnych szczepów edytuj
Znanych jest kilka szczepów, a genomy dwóch zostały w pełni zsekwencjonowane[143][144][145][146][147]. Genom szczepu "26695" składa się z 1,7 miliona par zasad z 1550 genami. Dwa zsekwencjonowane szczepy wykazują różnice w 6% nukleozydów. Inne szczepy Helicobacter pylori mają podobną wielkość genomu[148]. Badania nad genomem H. pylori są skoncentrowane na wyjaśnieniu patogenezy i zdolności bakterii do wywoływania choroby. Około 29% loci znajduje się w kategorii "patogenezy" bazy genomu. Oba zsekwencjonowane szczepy mają wyspę patogenności Cag o rozmiarach w przybliżeniu 40 kbp (sekwencje genowe, którym przypisuje się odpowiedzialność za patogenezę), która zawiera ponad 40 genów. Wyspa chorobotwórczości jest zwykle nieobecna u H. pylori izolowanej od ludzi, którzy są jej nosicielami, ale pozostają bezobjawowi[149].
Zobacz też edytuj
Uwagi edytuj
- ↑ Czułość, wrażliwość, dodatnia i ujemna wartość predykcyjna testu – 38%, 100%, 100%, 41% do 81%, 100%, 100%, 69%[84].
- ↑ Retrospektywnie: czułość – 87,5% swoistość – 54,5% wyniki fałszywie ujemne – 33,3%[86].
Przypisy edytuj
- ↑ a b c Helicobacter pylori, [w:] Bacterial Infections [online], WHO, 24 marca 2006 [zarchiwizowane z adresu 2006-03-24].
- ↑ 23: Campylobacter and Helicobacter. W: Samuel Baron: Medical Microbiology. Univ of Texas Medical Branch, 1996. ISBN 0-9631172-1-1.
- ↑ Yamaoka Y (editor).: Helicobacter pylori: Molecular Genetics and Cellular Biology. Caister Academic Press, 2008. ISBN 978-1-904455-31-8.
- ↑ L.M. Brown, Helicobacter pylori: epidemiology and routes of transmission, „Epidemiologic Reviews”, 22 (2), 2000, s. 283–297, DOI: 10.1093/oxfordjournals.epirev.a018040, PMID: 11218379 [dostęp 2021-03-02].
- ↑ M.J.Blaser, An Endangered Species in the Stomach, „Scientific American”, 292 (2), 2005, s. 38–45 [zarchiwizowane z adresu 2011-03-19].
- ↑ G. Bizzozero, Ueber die schlauchförmigen Drüsen des Magendarmkanals und die Beziehungen ihres Epithels zu dem Oberflächenepithel der Schleimhaut: Zweite Mittheilung, „Archiv für Mikroskopische Anatomie”, 40 (1), 1892, s. 325–375, DOI: 10.1007/BF02954497 [dostęp 2021-03-02] (niem.).
- ↑ Walery Jaworski, Podręcznik chorób żołądka i dietetyki szczegółowej, Wydawnictwa Dzieł Lekarskich Polskich, 1899, s. 30–47 [dostęp 2021-03-09].
- ↑ a b H.L. Kornberg, R.E. Davies, D.R. Wood, The activity and function of gastric urease in the cat, „The Biochemical Journal”, 56 (3), 1954, s. 363–372, DOI: 10.1042/bj0560363, PMID: 13140215, PMCID: PMC1269634 [dostęp 2021-03-02].
- ↑ a b B.J. Marshall i inni, Original isolation of Campylobacter pyloridis from human gastric mucosa, „Microbios Letters”, 25 (98), 1984, s. 83–88 [dostęp 2021-03-02] [zarchiwizowane z adresu 2021-07-11] (ang.).
- ↑ a b Maria Lucyna Zaremba, Jerzy Borowski, Mikrobiologia lekarska. Podręcznik dla studentów medycyny, wyd. 3, Warszawa: Wydawnictwo Lekarskie PZWL, 2004, s. 234–239, ISBN 83-200-2896-5, OCLC 749533192.
- ↑ a b A. Morris, G. Nicholson, Ingestion of Campylobacter pyloridis causes gastritis and raised fasting gastric pH, „The American Journal of Gastroenterology”, 82 (3), 1987, s. 192–199, PMID: 3826027 [dostęp 2021-03-02].
- ↑ a b B.J. Marshall i inni, Attempt to fulfil Koch's postulates for pyloric Campylobacter, „The Medical Journal of Australia”, 142 (8), 1985, s. 436–439, DOI: 10.5694/j.1326-5377.1985.tb113443.x, PMID: 3982345 [dostęp 2021-03-02].
- ↑ Medyczny Nobel 2005 – o Helicobacter pylori, „Gazeta Lekarska” [dostęp 2006-02-22] [zarchiwizowane z adresu 2008-01-29].
- ↑ E. Ocaña Andrade i inni, [Campylobacter pylori in endoscopic biopsies of the gastric antrum and its association with chronic gastritis], „Revista De Gastroenterologia De Mexico”, 54 (4), 1989, s. 207–211, PMID: 2616983 [dostęp 2021-03-02] (hiszp.).
- ↑ Harry L. T. Mobley, George L. Mendz, Stuart L. Hazell: Helicobacter Pylori: Physiology and Genetics. American Society Microbiology. ISBN 1-55581-213-9.
- ↑ Teresa Starzyńska, Peter Malfertheiner, Helicobacter and digestive malignancies, „Helicobacter”, 11 Suppl 1, 2006, s. 32–35, DOI: 10.1111/j.1478-405X.2006.00431.x, PMID: 16925609 [dostęp 2021-03-02].
- ↑ Bodo Linz i inni, An African origin for the intimate association between humans and Helicobacter pylori, „Nature”, 445 (7130), 2007, s. 915–918, DOI: 10.1038/nature05562, PMID: 17287725, PMCID: PMC1847463 [dostęp 2021-03-02].
- ↑ a b c Stephanie Bury-Moné i inni, Is Helicobacter pylori a true microaerophile?, „Helicobacter”, 11 (4), 2006, s. 296–303, DOI: 10.1111/j.1523-5378.2006.00413.x, PMID: 16882333 [dostęp 2021-03-02].
- ↑ Jonathan W. Olson, Robert J. Maier, Molecular hydrogen as an energy source for Helicobacter pylori, „Science”, 298 (5599), 2002, s. 1788–1790, DOI: 10.1126/science.1077123, PMID: 12459589 [dostęp 2021-03-02].
- ↑ R.M. Stark i inni, Biofilm formation by Helicobacter pylori, „Letters in Applied Microbiology”, 28 (2), 1999, s. 121–126, DOI: 10.1046/j.1365-2672.1999.00481.x, PMID: 10063642 [dostęp 2021-03-02].
- ↑ W.Y. Chan i inni, Coccoid forms of Helicobacter pylori in the human stomach, „American Journal of Clinical Pathology”, 102 (4), 1994, s. 503–507, DOI: 10.1093/ajcp/102.4.503, PMID: 7524304 [dostęp 2021-03-02].
- ↑ a b X. Jiang, M.P. Doyle, Effect of environmental and substrate factors on survival and growth of Helicobacter pylori, „Journal of Food Protection”, 61 (8), 1998, s. 929–933, DOI: 10.4315/0362-028x-61.8.929, PMID: 9713749 [dostęp 2021-03-02].
- ↑ a b c d Johannes G. Kusters, Arnoud H.M. van Vliet, Ernst J. Kuipers, Pathogenesis of Helicobacter pylori infection, „Clinical Microbiology Reviews”, 19 (3), 2006, s. 449–490, DOI: 10.1128/CMR.00054-05, PMID: 16847081, PMCID: PMC1539101 [dostęp 2021-03-02].
- ↑ a b c Adrian Lee, Francis Mégraud, Helicobacter pylori: techniques for clinical diagnosis & basic research, London: W.B. Saunders, 1996, ISBN 0-7020-2225-X.
- ↑ Danuta Dzierżanowska: Antybiotykoterapia praktyczna. Bielsko-Biała: [Alfa]-Medica Press, 2008, s. 307–309. ISBN 978-83-7522-013-1.
- ↑ C. Josenhans i inni, Switching of flagellar motility in Helicobacter pylori by reversible length variation of a short homopolymeric sequence repeat in fliP, a gene encoding a basal body protein, „Infection and Immunity”, 68 (8), 2000, s. 4598–4603, DOI: 10.1128/iai.68.8.4598-4603.2000, PMID: 10899861, PMCID: PMC98385 [dostęp 2021-03-02].
- ↑ Yoshio Yamaoka: Helicobacter pylori: Molecular Genetics and Cellular Biology. Caister Academic Pr. ISBN 1-904455-31-X.
- ↑ Sławomir Maśliński, Jan Ryżewski, Edward Bańkowski: Patofizjologia : podręcznik dla studentów medycyny. Warszawa: Wydawnictwo Lekarskie PZWL, 1998, s. 730. ISBN 83-200-2225-8.
- ↑ Ge Wang i inni, Dual Roles of Helicobacter pylori NapA in inducing and combating oxidative stress, „Infection and Immunity”, 74 (12), 2006, s. 6839–6846, DOI: 10.1128/IAI.00991-06, PMID: 17030577, PMCID: PMC1698064 [dostęp 2021-03-02].
- ↑ Ge Wang, Praveen Alamuri, Robert J. Maier, The diverse antioxidant systems of Helicobacter pylori, „Molecular Microbiology”, 61 (4), 2006, s. 847–860, DOI: 10.1111/j.1365-2958.2006.05302.x, PMID: 16879643 [dostęp 2021-03-02].
- ↑ Z. Ge, D.E. Taylor, Contributions of genome sequencing to understanding the biology of Helicobacter pylori, „Annual Review of Microbiology”, 53, 1999, s. 353–387, DOI: 10.1146/annurev.micro.53.1.353, PMID: 10547695 [dostęp 2021-03-02].
- ↑ F. Tombola i inni, The Helicobacter pylori VacA toxin is a urea permease that promotes urea diffusion across epithelia, „The Journal of Clinical Investigation”, 108 (6), 2001, s. 929–937, DOI: 10.1172/JCI13045, PMID: 11560962, PMCID: PMC200932 [dostęp 2021-03-02].
- ↑ Witold Bartnik, W sprawie wytycznych Polskiego Towarzystwa Gastroenterologii dotyczących "Postępowania w zakażeniu Helicobacter pylori (rok 2004)" [online], Medycyna Praktyczna, 20 grudnia 2004 [dostęp 2021-03-09].
- ↑ Witold Bartnik, Helicobacter pylori – diagnostyka i leczenie [online], Medycyna Praktyczna [dostęp 2021-03-09].
- ↑ M. Granström, Y. Tindberg, M. Blennow, Seroepidemiology of Helicobacter pylori infection in a cohort of children monitored from 6 months to 11 years of age, „Journal of Clinical Microbiology”, 35 (2), 1997, s. 468–470, DOI: 10.1128/JCM.35.2.468-470.1997, PMID: 9003617, PMCID: PMC229601 [dostęp 2021-03-02].
- ↑ P.D. Klein i inni, The epidemiology of Helicobacter pylori in Peruvian children between 6 and 30 months of age, „The American Journal of Gastroenterology”, 89 (12), 1994, s. 2196–2200, PMID: 7977241 [dostęp 2021-03-02].
- ↑ F. Mégraud, Transmission of Helicobacter pylori: faecal-oral versus oral-oral route, „Alimentary Pharmacology & Therapeutics”, 9 Suppl 2, 1995, s. 85–91, DOI: 10.1111/j.1365-2036.1995.tb00357.x, PMID: 8547533 [dostęp 2021-03-02].
- ↑ D.R. Cave, Transmission and epidemiology of Helicobacter pylori, „The American Journal of Medicine”, 100 (5A), 1996, 12S–17S; discussion 17S–18S, DOI: 10.1016/s0002-9343(96)80224-5, PMID: 8644777 [dostęp 2021-03-02].
- ↑ Guy D. Eslick, Sexual transmission of Helicobacter pylori via oral-anal intercourse, „International journal of STD & AIDS”, 13 (1), 2002, s. 7–11, DOI: 10.1258/0956462021924541, PMID: 11802923 [dostęp 2021-03-02].
- ↑ a b c d e Jacek J Pietrzyk, Adam Bysiek: Wybrane zagadnienia z pediatrii Podręcznik dla studentów medycyny i lekarzy. T. 3, Choroby układu pokarmowego, choroby układu nerwowego, choroby układu moczowego. Kraków: Wydaw. Uniwersytetu Jagiellońskiego, 2004, s. 71–77. ISBN 83-233-1859-X.
- ↑ D.T. Smoot, How does Helicobacter pylori cause mucosal damage? Direct mechanisms, „Gastroenterology”, 113 (6 Suppl), 1997, S31–34; discussion S50, DOI: 10.1016/s0016-5085(97)80008-x, PMID: 9394757 [dostęp 2021-03-02].
- ↑ Martin J. Blaser, John C. Atherton, Helicobacter pylori persistence: biology and disease, „The Journal of Clinical Investigation”, 113 (3), 2004, s. 321–333, DOI: 10.1172/JCI20925, PMID: 14755326, PMCID: PMC324548 [dostęp 2021-03-02].
- ↑ Mitchell L. Schubert, David A. Peura, Control of gastric acid secretion in health and disease, „Gastroenterology”, 134 (7), 2008, s. 1842–1860, DOI: 10.1053/j.gastro.2008.05.021, PMID: 18474247 [dostęp 2021-03-02].
- ↑ E. M. el-Omar i inni, Helicobacter pylori infection and abnormalities of acid secretion in patients with duodenal ulcer disease, „Gastroenterology”, 109 (3), 1995, s. 681–691, DOI: 10.1016/0016-5085(95)90374-7, PMID: 7657096 [dostęp 2021-03-02].
- ↑ W.L. Peterson i inni, Acid secretion and serum gastrin in normal subjects and patients with duodenal ulcer: the role of Helicobacter pylori, „The American Journal of Gastroenterology”, 88 (12), 1993, s. 2038–2043, PMID: 8249971 [dostęp 2021-03-02].
- ↑ J. Calam, The somatostatin-gastrin link of Helicobacter pylori infection, „Annals of Medicine”, 27 (5), 1995, s. 569–573, DOI: 10.3109/07853899509002471, PMID: 8541034 [dostęp 2021-03-02].
- ↑ C.J. Tsai, Helicobacter pylori infection and peptic ulcer disease in cirrhosis, „Digestive Diseases and Sciences”, 43 (6), 1998, s. 1219–1225, DOI: 10.1023/a:1018899506271, PMID: 9635611 [dostęp 2021-03-02].
- ↑ a b c Vinay Kumar, Ramzi S. Cotran, Stanley L. Robbins: Robbins basic pathology. Philadelphia: Saunders, 2003, s. 634–644 672–673. ISBN 0-7216-9274-5.
- ↑ Yoshio Yamaoka, Mototsugu Kato, Masahiro Asaka, Geographic differences in gastric cancer incidence can be explained by differences between Helicobacter pylori strains, „Internal Medicine”, 47 (12), 2008, s. 1077–1083, DOI: 10.2169/internalmedicine.47.0975, PMID: 18552463, PMCID: PMC3732488 [dostęp 2021-03-02].
- ↑ Changcheng Wang, Yuhong Yuan, Richard H. Hunt, The association between Helicobacter pylori infection and early gastric cancer: a meta-analysis, „The American Journal of Gastroenterology”, 102 (8), 2007, s. 1789–1798, DOI: 10.1111/j.1572-0241.2007.01335.x, PMID: 17521398 [dostęp 2021-03-02].
- ↑ Stephenie C. Swisher, Alfonso J. Barbati, Helicobacter pylori strikes again: gastric mucosa-associated lymphoid tissue (MALT) lymphoma, „Gastroenterology Nursing”, 30 (5), 2007, 348–354; quiz 355–356, DOI: 10.1097/01.SGA.0000296255.16576.e5, PMID: 18049205 [dostęp 2021-03-02].
- ↑ L.M. Asenjo, J.P. Gisbert, Prevalence of Helicobacter pylori infection in gastric MALT lymphoma: a systematic review, „Revista Espanola De Enfermedades Digestivas”, 99 (7), 2007, s. 398–404, DOI: 10.4321/s1130-01082007000700006, PMID: 17973584 [dostęp 2021-03-02] (ang. • hiszp.).
- ↑ Sung-Bok Lee, Jae-Wook Yang, Chang-Sik Kim, The association between conjunctival MALT lymphoma and Helicobacter pylori, „The British Journal of Ophthalmology”, 92 (4), 2008, s. 534–536, DOI: 10.1136/bjo.2007.132316, PMID: 18369070 [dostęp 2021-03-02].
- ↑ S. Begum i inni, Mucosal change of the stomach with low-grade mucosa-associated lymphoid tissue lymphoma after eradication of Helicobacter pylori: follow-up study of 48 cases, „The Journal of Medical Investigation”, 47 (1-2), 2000, s. 36–46, PMID: 10740978 [dostęp 2021-03-02].
- ↑ D. Boixeda de Miquel i inni, Effect of Helicobacter pylori eradication therapy in rosacea patients, „Revista Espanola De Enfermedades Digestivas”, 98 (7), 2006, s. 501–509, DOI: 10.4321/s1130-01082006000700003, PMID: 17022699 [dostęp 2021-03-02] (ang. • hiszp.).
- ↑ a b c P. Malfertheiner i inni, Current concepts in the management of Helicobacter pylori infection: the Maastricht III Consensus Report, „Gut”, 56 (6), 2007, s. 772–781, DOI: 10.1136/gut.2006.101634, PMID: 17170018, PMCID: PMC1954853 [dostęp 2021-03-02].
- ↑ Cristina Cijevschi Prelipcean i inni, Extragastric manifestations of Helicobacter pylori infection, „Revista Medico-Chirurgicala a Societatii De Medici Si Naturalisti Din Iasi”, 111 (3), 2007, s. 575–583, PMID: 18293684 [dostęp 2021-03-02].
- ↑ Natalia Zumkeller i inni, Helicobacter pylori infection and colorectal cancer risk: a meta-analysis, „Helicobacter”, 11 (2), 2006, s. 75–80, DOI: 10.1111/j.1523-5378.2006.00381.x, PMID: 16579836 [dostęp 2021-03-02].
- ↑ Ya-Shuang Zhao i inni, Meta-analysis of different test indicators: Helicobacter pylori infection and the risk of colorectal cancer, „International Journal of Colorectal Disease”, 23 (9), 2008, s. 875–882, DOI: 10.1007/s00384-008-0479-z, PMID: 18506454 [dostęp 2021-03-02].
- ↑ Theodoros Rokkas i inni, Relationship between Helicobacter pylori infection and esophageal neoplasia: a meta-analysis, „Clinical Gastroenterology and Hepatology”, 5 (12), 2007, s. 1413–1417, DOI: 10.1016/j.cgh.2007.08.010, PMID: 17997357 [dostęp 2021-03-02].
- ↑ R.V. Lord i inni, Prevalence of Helicobacter pylori infection in 160 patients with Barrett's oesophagus or Barrett's adenocarcinoma, „The Australian and New Zealand Journal of Surgery”, 70 (1), 2000, s. 26–33, DOI: 10.1046/j.1440-1622.2000.01737.x, PMID: 10696939 [dostęp 2021-03-02].
- ↑ M. Kudo i inni, CagA in Barrett's oesophagus in Colombia, a country with a high prevalence of gastric cancer, „Journal of Clinical Pathology”, 58 (3), 2005, s. 259–262, DOI: 10.1136/jcp.2004.022251, PMID: 15735156, PMCID: PMC1770586 [dostęp 2021-03-02].
- ↑ M.F. Vaezi i inni, CagA-positive strains of Helicobacter pylori may protect against Barrett's esophagus, „The American Journal of Gastroenterology”, 95 (9), 2000, s. 2206–2211, DOI: 10.1111/j.1572-0241.2000.02305.x, PMID: 11007219 [dostęp 2021-03-02].
- ↑ Shi-Ying Xuan i inni, Association between the presence of H pylori in the liver and hepatocellular carcinoma: a meta-analysis, „World Journal of Gastroenterology”, 14 (2), 2008, s. 307–312, DOI: 10.3748/wjg.14.307, PMID: 18186573, PMCID: PMC2675132 [dostęp 2021-03-04].
- ↑ Shi-Ying Xuan i inni, Helicobacter infection in hepatocellular carcinoma tissue, „World Journal of Gastroenterology”, 12 (15), 2006, s. 2335–2340, DOI: 10.3748/wjg.v12.i15.2335, PMID: 16688821, PMCID: PMC4088066 [dostęp 2021-03-04].
- ↑ Nicola Leone i inni, Helicobacter pylori seroprevalence in patients with cirrhosis of the liver and hepatocellular carcinoma, „Cancer Detection and Prevention”, 27 (6), 2003, s. 494–497, DOI: 10.1016/j.cdp.2003.07.004, PMID: 14642558 [dostęp 2021-03-04].
- ↑ M. Rocha i inni, Association of Helicobacter species with hepatitis C cirrhosis with or without hepatocellular carcinoma, „Gut”, 54 (3), 2005, s. 396–401, DOI: 10.1136/gut.2004.042168, PMID: 15710989, PMCID: PMC1774397 [dostęp 2021-03-04].
- ↑ Maria P. Dore i inni, Helicobacter infection in patients with HCV-related chronic hepatitis, cirrhosis, and hepatocellular carcinoma, „Digestive Diseases and Sciences”, 47 (7), 2002, s. 1638–1643, DOI: 10.1023/a:1015848009444, PMID: 12141829 [dostęp 2021-03-04].
- ↑ Nicola Coppola i inni, Helicobacter spp. and liver diseases, „Le Infezioni in Medicina”, 11 (4), 2003, s. 201–207, PMID: 14988668 [dostęp 2021-03-04] (ang.).
- ↑ Mohammed S. Al-Marhoon, Is there a role for Helicobacter pylori infection in urological diseases?, „Urology Journal”, 5 (3), 2008, s. 139–143, PMID: 18825618 [dostęp 2021-03-04].
- ↑ Michael G. Bruce, Heidi Ingrid Maaroos, Epidemiology of Helicobacter pylori infection, „Helicobacter”, 13 Suppl 1, 2008, s. 1–6, DOI: 10.1111/j.1523-5378.2008.00631.x, PMID: 18783514 [dostęp 2021-03-04].
- ↑ S. Tsuji i inni, Review article: inflammation-related promotion of gastrointestinal carcinogenesis--a perigenetic pathway, „Alimentary Pharmacology & Therapeutics”, 18 Suppl 1, 2003, s. 82–89, DOI: 10.1046/j.1365-2036.18.s1.22.x, PMID: 12925144 [dostęp 2021-03-04].
- ↑ Masami Suganuma i inni, TNF-alpha-inducing protein, a carcinogenic factor secreted from H. pylori, enters gastric cancer cells, „International Journal of Cancer”, 123 (1), 2008, s. 117–122, DOI: 10.1002/ijc.23484, PMID: 18412243 [dostęp 2021-03-04].
- ↑ a b A. Repici i inni, La diagnosi “invasiva” dell’infezione da Helicobacter pylori nella pratica clinica del 2006, „Minerva Medica”, 97 (1), 2006, s. 25–29, PMID: 16565695 [dostęp 2021-03-04] (wł.).
- ↑ R.P. Logan i inni, Changes in the intragastric distribution of Helicobacter pylori during treatment with omeprazole, „Gut”, 36 (1), 1995, s. 12–16, DOI: 10.1136/gut.36.1.12, PMID: 7890214, PMCID: PMC1382345 [dostęp 2021-03-04].
- ↑ G. Jarczyk i inni, [Urease test, microbiologic tests, histologic and serologic tests for the evaluation of Helicobacter pylori infections in persons with peptic ulcer and gastritis], „Polski Tygodnik Lekarski”, 51 (14-18), 1996, s. 219–222, PMID: 8966163 [dostęp 2021-03-04] (pol.).
- ↑ Oscar Aguilar-Soto i inni, [Comparative study between rapid urease test, imprint and histopathological study for Helicobacter pylori diagnosis], „Revista De Gastroenterologia De Mexico”, 69 (3), 2004, s. 136–142, PMID: 15759784 [dostęp 2021-03-04] (hiszp.).
- ↑ L. Trevisani i inni, Usefulness of brushing urease test for diagnosis of Helicobacter pylori infection, „Italian Journal of Gastroenterology and Hepatology”, 30 (6), 1998, s. 599–601, PMID: 10076780 [dostęp 2021-03-04].
- ↑ N. Lee, H.N. Tsai, K.M. Fang, Comparison of four different methods for detection of Helicobacter pylori from gastric biopsies, „Zhonghua Minguo Wei Sheng Wu Ji Mian Yi Xue Za Zhi = Chinese Journal of Microbiology and Immunology”, 23 (3), 1990, s. 220–231, PMID: 2091902 [dostęp 2021-03-04].
- ↑ a b M. Song, [Detection of Helicobacter pylori in human saliva by using nested polymerase chain reaction], „Zhonghua Liu Xing Bing Xue Za Zhi”, 14 (4), 1993, s. 237–240, PMID: 8143325 [dostęp 2021-03-04] (chiń.).
- ↑ a b c E. Pérez-Trallero, M. Montes, String test for Helicobacter pylori, „Journal of Clinical Microbiology”, 38 (11), 2000, s. 4303, PMID: 11185067, PMCID: PMC87595 [dostęp 2021-03-09].
- ↑ Billie Velapatiño i inni, Validation of string test for diagnosis of Helicobacter pylori infections, „Journal of Clinical Microbiology”, 44 (3), 2006, s. 976–980, DOI: 10.1128/JCM.44.3.976-980.2006, PMID: 16517886, PMCID: PMC1393125 [dostęp 2021-03-04].
- ↑ Andreas Leodolter i inni, Breath and string test: a diagnostic package for the identification of treatment failure and antibiotic resistance of Helicobacter pylori without the necessity of upper gastrointestinal endoscopy, „World Journal of Gastroenterology”, 11 (4), 2005, s. 584–586, DOI: 10.3748/wjg.v11.i4.584, PMID: 15641151, PMCID: PMC4250816 [dostęp 2021-03-04].
- ↑ Rupert W.L. Leong i inni, Evaluation of the string test for the detection of Helicobacter pylori, „World Journal of Gastroenterology”, 9 (2), 2003, s. 309–311, DOI: 10.3748/wjg.v9.i2.309, PMID: 12532455, PMCID: PMC4611335 [dostęp 2021-03-04].
- ↑ Helen M. Windsor, Emmanuel A. Abioye-Kuteyi, Barry J. Marshall, Methodology and transport medium for collection of Helicobacter pylori on a string test in remote locations, „Helicobacter”, 10 (6), 2005, s. 630–634, DOI: 10.1111/j.1523-5378.2005.00355.x, PMID: 16302991 [dostęp 2021-03-04].
- ↑ E. García-Díaz i inni, Valor de la serología (IgG-ELISA) como método diagnóstico alternativo de infección por Helicobacter pylori en pacientes con hemorragia digestiva por úlcera gastroduodenal, „Revista Espanola De Enfermedades Digestivas”, 94 (12), 2002, s. 725–736, PMID: 12733331 [dostęp 2021-03-04] (hiszp.).
- ↑ a b Angelo Locatelli i inni, Detection of anti-Helicobacter pylori antibodies in serum and duodenal fluid in peptic gastroduodenal disease., „World Journal of Gastroenterology”, 10 (20), 2004, s. 2997–3000, DOI: 10.3748/wjg.v10.i20.2997, PMID: 15378781, PMCID: PMC4576260.
- ↑ Maria Korzonek, Wartość diagnostyczna różnych metod stosowanych w wykrywaniu zakażenia Helicobacter pylori w błonie śluzowej żołądka, „Annales Academiae Medicae Stetinensis”, 43, 1997, s. 143–159, PMID: 9471913 [dostęp 2021-03-09].
- ↑ Miroslava Katicic, [Is the only good Helicobacter a dead Helicobacter?], „Medicinski arhiv”, 56 (1 Suppl 1), 2002, s. 17–20, PMID: 12055716.
- ↑ T.S. Chua i inni, Validation of 13C-urea breathtest for the diagnosis of Helicobacter pylori infection in the Singapore population, „Singapore Medical Journal”, 43 (8), 2002, s. 408–411, PMID: 12507026 [dostęp 2021-03-09].
- ↑ R.L. Riepl i inni, Accuracy of 13C-urea breath test in clinical use for diagnosis of Helicobacter pylori infection, „Zeitschrift Fur Gastroenterologie”, 38 (1), 2000, s. 13–19, DOI: 10.1055/s-2000-15278, PMID: 10689743 [dostęp 2021-03-09].
- ↑ Kengo Tokunaga i inni, Helicobacter pylori 除菌判定における13C-尿素呼気試験の有用性と問題点 徳永 健吾, 渡辺 一宏, 田中 昭文, 菅野 朝, 今瀬 教人, 石田 均, 高橋 信一 [Evaluation of 13C-urea breath test to confirm eradication of Helicobacter pylori], „Nihon Shokakibyo Gakkai Zasshi”, 102 (2), 2005, s. 176–182, DOI: 10.11405/nisshoshi.102.176, PMID: 15747534 [dostęp 2021-03-09] (jap.).
- ↑ V. Ahuja, C.S. Bal, M.P. Sharma, Can the C-14 urea breath test replace follow-up endoscopic biopsies in patients treated for Helicobacter pylori infection?, „Clinical Nuclear Medicine”, 23 (12), 1998, s. 815–819, DOI: 10.1097/00003072-199812000-00005, PMID: 9858292 [dostęp 2021-03-09].
- ↑ V. Tewari i inni, 14C-urea breath test for assessment of gastric Helicobacter pylori colonization and eradication, „Indian Journal of Gastroenterology”, 20 (4), 2001, s. 140–143, PMID: 11497171 [dostęp 2021-03-09].
- ↑ a b Chander M. Pathak i inni, Kinetics of 14carbon dioxide excretion from 14C-urea by oral commensal flora, „Journal of Gastroenterology and Hepatology”, 23 (10), 2008, s. 1603–1607, DOI: 10.1111/j.1440-1746.2008.05323.x, PMID: 18444994 [dostęp 2021-03-09].
- ↑ C.M. Pathak i inni, Evaluation of 14C-urinary excretion and its comparison with 14CO2 in breath after 14C-urea administration in Helicobacter pylori infection, „The American Journal of Gastroenterology”, 89 (5), 1994, s. 734–738, PMID: 8172148 [dostęp 2021-03-09].
- ↑ R. Moulton-Barrett i inni, Serum 13C-bicarbonate in the assessment of gastric Helicobacter pylori urease activity, „The American Journal of Gastroenterology”, 88 (3), 1993, s. 369–374, PMID: 7679876 [dostęp 2021-03-09].
- ↑ L. Trevisani i inni, Usefulness of brushing urease test for diagnosis of Helicobacter pylori infection, „Italian Journal of Gastroenterology and Hepatology”, 30 (6), 1998, s. 599–601, PMID: 10076780 [dostęp 2021-03-09].
- ↑ a b c d Shahjahan Kabir, Detection of Helicobacter pylori DNA in feces and saliva by polymerase chain reaction: a review, „Helicobacter”, 9 (2), 2004, s. 115–123, DOI: 10.1111/j.1083-4389.2004.00207.x, PMID: 15068412 [dostęp 2021-03-09].
- ↑ C.W. Howden, R.H. Hunt, Guidelines for the management of Helicobacter pylori infection. Ad Hoc Committee on Practice Parameters of the American College of Gastroenterology, „The American Journal of Gastroenterology”, 93 (12), 1998, s. 2330–2338, DOI: 10.1111/j.1572-0241.1998.00684.x, PMID: 9860388 [dostęp 2021-03-09]. Przedruk w j. polskim: Diagnostyka i leczenie zakażenia Helicobacter pylori [online], Medycyna Praktyczna [dostęp 2021-03-09].
- ↑ a b Cindy M. Dierikx i inni, Serum- and animal tissue-free medium for transport and growth of Helicobacter pylori, „FEMS immunology and medical microbiology”, 50 (2), 2007, s. 239–243, DOI: 10.1111/j.1574-695X.2007.00211.x, PMID: 17298584 [dostęp 2021-03-09].
- ↑ M.G. Morshed i inni, Growth medium containing cyclodextrin and low concentration of horse serum for cultivation of Helicobacter pylori, „Microbiology and Immunology”, 38 (11), 1994, s. 897–900, DOI: 10.1111/j.1348-0421.1994.tb02143.x, PMID: 7898389 [dostęp 2021-03-09].
- ↑ R. Olivieri i inni, Growth of Helicobacter pylori in media containing cyclodextrins, „Journal of Clinical Microbiology”, 31 (1), 1993, s. 160–162, DOI: 10.1128/JCM.31.1.160-162.1993, PMID: 8417026, PMCID: PMC262644 [dostęp 2021-03-09].
- ↑ Alba E. Vega i inni, Growth of Helicobacter pylori in medium supplemented with cyanobacterial extract, „Journal of Clinical Microbiology”, 41 (12), 2003, s. 5384–5388, DOI: 10.1128/jcm.41.12.5384-5388.2003, PMID: 14662915, PMCID: PMC309022 [dostęp 2021-03-09].
- ↑ C.K. Yang i inni, [Modified selective medium for isolation of Helicobacter pylori], „Chinese Journal of Microbiology and Immunology”, 25 (2), 1992, s. 108–114, PMID: 1473370 [dostęp 2021-03-09] (chiń.).
- ↑ Miyuki Hasegawa i inni, 新 し く開発 したHelicobacter pylori選 択 分 離 培 地Columbia horse biood agar HPの 有 用性 に関 す る複 数施 設 評 価 [A multicenter study of a new Helicobacter pylori selective medium. Columbia horse blood agar HP], „Kansenshogaku Zasshi”, 76 (5), 2002, s. 341–346, DOI: 10.11150/kansenshogakuzasshi1970.76.341, PMID: 12073569 [dostęp 2021-03-09] (jap.).
- ↑ M. Shahamat i inni, Evaluation of liquid media for growth of Helicobacter pylori, „Journal of Clinical Microbiology”, 29 (12), 1991, s. 2835–2837, DOI: 10.1128/JCM.29.12.2835-2837.1991, PMID: 1757556, PMCID: PMC270442 [dostęp 2021-03-09].
- ↑ H.X. Xia, C.T. Keane, C.A. O'Morain, Determination of the optimal transport system for Helicobacter pylori cultures, „Journal of Medical Microbiology”, 39 (5), 1993, s. 334–337, DOI: 10.1099/00222615-39-5-334, PMID: 8246249 [dostęp 2021-03-09].
- ↑ Eugenia Gospodarek, E. Sieradzka, Wojciech Zegarski, Wykorzystanie 4 metod mikrobiologicznych w wykrywaniu Helicobacter pylori, „Medycyna Doswiadczalna i Mikrobiologia”, 46 (4), 1994, s. 293–300, PMID: 7603130 [dostęp 2021-03-09].
- ↑ a b B.E. Kolts i inni, Helicobacter pylori detection: a quality and cost analysis, „The American Journal of Gastroenterology”, 88 (5), 1993, s. 650–655, PMID: 7683175 [dostęp 2021-03-09].
- ↑ L. Laine i inni, Prospective comparison of H&E, Giemsa, and Genta stains for the diagnosis of Helicobacter pylori, „Gastrointestinal Endoscopy”, 45 (6), 1997, s. 463–467, DOI: 10.1016/s0016-5107(97)70174-3, PMID: 9199901 [dostęp 2021-03-09].
- ↑ H.M. El-Zimaity i inni, Histologic assessment of Helicobacter pylori status after therapy: comparison of Giemsa, Diff-Quik, and Genta stains, „Modern Pathology: An Official Journal of the United States and Canadian Academy of Pathology, Inc”, 11 (3), 1998, s. 288–291, PMID: 9521477 [dostęp 2021-03-09].
- ↑ Diclehan Orhan i inni, Immunohistochemical detection of Helicobacter pylori infection in gastric biopsies of urea breath test-positive and -negative pediatric patients, „The Turkish Journal of Pediatrics”, 50 (1), 2008, s. 34–39, PMID: 18365589 [dostęp 2021-03-09].
- ↑ J.K. Eshun i inni, Comparison of immunohistochemistry and silver stain for the diagnosis of pediatric Helicobacter pylori infection in urease-negative gastric biopsies, „Pediatric and Developmental Pathology”, 4 (1), 2001, s. 82–88, DOI: 10.1007/s100240010129, PMID: 11200495 [dostęp 2021-03-09].
- ↑ Witold Bartnik, Eradykacja Helicobacter pylori [online], Medycyna Praktyczna, 2013 [dostęp 2021-03-09].
- ↑ A.M. Hirschl i inni, [Campylobacter pylori, gastritis and peptic ulcer], „Wiener Klinische Wochenschrift”, 99 (14), 1987, s. 493–497, PMID: 3630180 [dostęp 2021-03-09] (niem.).
- ↑ R.H. Hunt, C.A. Fallone, A.B. Thomson, Canadian Helicobacter pylori Consensus Conference update: infections in adults. Canadian Helicobacter Study Group, „Canadian Journal of Gastroenterology = Journal Canadien De Gastroenterologie”, 13 (3), 1999, s. 213–217, DOI: 10.1155/1999/180751, PMID: 10331931 [dostęp 2021-03-09].
- ↑ P. Malfertheiner i inni, Current concepts in the management of Helicobacter pylori infection – the Maastricht 2-2000 Consensus Report, „Alimentary Pharmacology & Therapeutics”, 16 (2), 2002, s. 167–180, DOI: 10.1046/j.1365-2036.2002.01169.x, PMID: 11860399 [dostęp 2021-03-09].
- ↑ Björn Stenström, Aruni Mendis, Barry Marshall, Helicobacter pylori – the latest in diagnosis and treatment, „Australian Family Physician”, 37 (8), 2008, s. 608–612, PMID: 18704207 [dostęp 2021-03-09].
- ↑ L. Fischbach, E.L. Evans, Meta-analysis: the effect of antibiotic resistance status on the efficacy of triple and quadruple first-line therapies for Helicobacter pylori, „Alimentary Pharmacology & Therapeutics”, 26 (3), 2007, s. 343–357, DOI: 10.1111/j.1365-2036.2007.03386.x, PMID: 17635369 [dostęp 2021-03-09].
- ↑ a b Badirou Aguemon i inni, Primary antibiotic resistance and effectiveness of Helicobacter pylori triple therapy in ulcero-inflammatory pathologies of the upper digestive tract, „Acta Gastro-Enterologica Belgica”, 68 (3), 2005, s. 287–293, PMID: 16268413 [dostęp 2021-03-09].
- ↑ H.J. O'Connor, Eradication of Helicobacter pylori, „European Journal of Gastroenterology & Hepatology”, 6 Suppl 1, 1994, S113–S119, PMID: 7735927 [dostęp 2021-03-09].
- ↑ Perttu Et Arkkila i inni, Helicobacter pylori eradication as the sole treatment for gastric and duodenal ulcers, „European Journal of Gastroenterology & Hepatology”, 17 (1), 2005, s. 93–101, DOI: 10.1097/00042737-200501000-00018, PMID: 15647648 [dostęp 2021-03-09].
- ↑ A.C. Ford i inni, Eradication therapy for peptic ulcer disease in Helicobacter pylori positive patients, „The Cochrane Database of Systematic Reviews” (2), 2006, art. nr CD003840, DOI: 10.1002/14651858.CD003840.pub5, PMID: 16625592 [dostęp 2021-03-09].
- ↑ Carlos Robles-Jara i inni, Is a 7-day Helicobater pylori treatment enough for eradication and inactivation of gastric inflammatory activity?, „World Journal of Gastroenterology”, 14 (18), 2008, s. 2838–2843, DOI: 10.3748/wjg.14.2838, PMID: 18473407, PMCID: PMC2710724 [dostęp 2021-03-09].
- ↑ R. Vicente i inni, Erradicación de Helicobacter pylori en pacientes con úlcera péptica tras fracaso de dos tratamientos previos: estudio prospectivo guiado por cultivo, „Gastroenterologia y Hepatologia”, 25 (7), 2002, s. 438–442, DOI: 10.1016/s0210-5705(02)70283-5, PMID: 12139836 [dostęp 2021-03-09] (hiszp.).
- ↑ Eradykacja Helicobacter pylori – siedem grzechów głównych [online], www.termedia.pl [dostęp 2023-09-08] (pol.).
- ↑ a b David Y. Graham, Akiko Shiotani, New concepts of resistance in the treatment of Helicobacter pylori infections, „Nature Clinical Practice. Gastroenterology & Hepatology”, 5 (6), 2008, s. 321–331, DOI: 10.1038/ncpgasthep1138, PMID: 18446147, PMCID: PMC2841357 [dostęp 2021-03-09].
- ↑ Dino Vaira i inni, Terapia dell'infezione da Helicobacter pylori. Attuali criteri, „Recenti Progressi in Medicina”, 98 (11), 2007, s. 574–582, DOI: 10.1701/303.3583, PMID: 18044409 [dostęp 2021-03-09] (wł.).
- ↑ Barry Marshall, Sequential therapy for Helicobacter pylori: a worthwhile effort for your patients, „Annals of Internal Medicine”, 148 (12), 2008, s. 962–963, DOI: 10.7326/0003-4819-148-12-200806170-00227, PMID: 18490666 [dostęp 2021-03-09].
- ↑ a b c d Yekta Tüzün i inni, The prevalence of primary and secondary Helicobacter pylori resistance to clarithromycin and probable contributing cofactors: data from southeastern Anatolia, „Hepato-Gastroenterology”, 55 (81), 2008, s. 289–293, PMID: 18507127 [dostęp 2021-03-09].
- ↑ a b H pylori antibiotic resistance: prevalence, importance, and advances in testing | Gut [online], gut.bmj.com [dostęp 2017-11-23] (ang.).
- ↑ F. Perna i inni, Levofloxacin-based triple therapy for Helicobacter pylori re-treatment: role of bacterial resistance, „Digestive and Liver Disease”, 39 (11), 2007, s. 1001–1005, DOI: 10.1016/j.dld.2007.06.016, PMID: 17889627 [dostęp 2021-03-09].
- ↑ P.I. Hsu i inni, Quadruple rescue therapy for Helicobacter pylori infection after two treatment failures, „European Journal of Clinical Investigation”, 38 (6), 2008, s. 404–409, DOI: 10.1111/j.1365-2362.2008.01951.x, PMID: 18435764 [dostęp 2021-03-09].
- ↑ Intetsu Kobayashi i inni, Changing antimicrobial susceptibility epidemiology of Helicobacter pylori strains in Japan between 2002 and 2005, „Journal of Clinical Microbiology”, 45 (12), 2007, s. 4006–4010, DOI: 10.1128/JCM.00740-07, PMID: 17942652, PMCID: PMC2168569 [dostęp 2021-03-09].
- ↑ Mark V. Galan, Arfana A. Kishan, Ann L. Silverman, Oral broccoli sprouts for the treatment of Helicobacter pylori infection: a preliminary report, „Digestive Diseases and Sciences”, 49 (7-8), 2004, s. 1088–1090, DOI: 10.1023/b:ddas.0000037792.04787.8a, PMID: 15387326 [dostęp 2021-03-09].
- ↑ Jed W. Fahey i inni, Sulforaphane inhibits extracellular, intracellular, and antibiotic-resistant strains of Helicobacter pylori and prevents benzo[a]pyrene-induced stomach tumors, „Proceedings of the National Academy of Sciences of the United States of America”, 99 (11), 2002, s. 7610–7615, DOI: 10.1073/pnas.112203099, PMID: 12032331, PMCID: PMC124299 [dostęp 2021-03-09].
- ↑ P. Marone i inni, Bactericidal activity of Pistacia lentiscus mastic gum against Helicobacter pylori, „Journal of Chemotherapy (Florence, Italy)”, 13 (6), 2001, s. 611–614, DOI: 10.1179/joc.2001.13.6.611, PMID: 11806621 [dostęp 2021-03-09].
- ↑ F.U. Huwez i inni, Mastic gum kills Helicobacter pylori, „The New England Journal of Medicine”, 339 (26), 1998, s. 1946, DOI: 10.1056/NEJM199812243392618, PMID: 9874617 [dostęp 2021-03-09].
- ↑ Sotirios Paraschos i inni, In vitro and in vivo activities of Chios mastic gum extracts and constituents against Helicobacter pylori, „Antimicrobial Agents and Chemotherapy”, 51 (2), 2007, s. 551–559, DOI: 10.1128/AAC.00642-06, PMID: 17116667, PMCID: PMC1797732 [dostęp 2021-03-09].
- ↑ James R. Bebb i inni, Mastic gum has no effect on Helicobacter pylori load in vivo, „The Journal of Antimicrobial Chemotherapy”, 52 (3), 2003, s. 522–523, DOI: 10.1093/jac/dkg366, PMID: 12888582 [dostęp 2021-03-09].
- ↑ Michael F. Loughlin, Dlawer A. Ala'Aldeen, Peter J. Jenks, Monotherapy with mastic does not eradicate Helicobacter pylori infection from mice, „The Journal of Antimicrobial Chemotherapy”, 51 (2), 2003, s. 367–371, DOI: 10.1093/jac/dkg057, PMID: 12562704 [dostęp 2021-03-09].
- ↑ J.F. Tomb i inni, The complete genome sequence of the gastric pathogen Helicobacter pylori, „Nature”, 388 (6642), 1997, s. 539–547, DOI: 10.1038/41483, PMID: 9252185 [dostęp 2021-03-09].
- ↑ Informacje o genomie szczepów H. pylori 26695 i J99. Institut Pasteur, 2002. [dostęp 2008-09-01]. (ang.).
- ↑ Kompletny genom Helicobacter pylori 26695. National Center for Biotechnology Information. [dostęp 2008-09-01]. (ang.).
- ↑ Kompletny genom Helicobacter pylori J99. National Center for Biotechnology Information. [dostęp 2008-09-01]. (ang.).
- ↑ Jung D. Oh i inni, The complete genome sequence of a chronic atrophic gastritis Helicobacter pylori strain: evolution during disease progression, „Proceedings of the National Academy of Sciences of the United States of America”, 103 (26), 2006, s. 9999–10004, DOI: 10.1073/pnas.0603784103, PMID: 16788065, PMCID: PMC1480403 [dostęp 2021-03-09].
- ↑ Beata Bednarczuk: Słownik bakterii. Warszawa: adamantan, 2008. ISBN 978-83-7350-076-1.
- ↑ David N. Baldwin i inni, Identification of Helicobacter pylori genes that contribute to stomach colonization, „Infection and Immunity”, 75 (2), 2007, s. 1005–1016, DOI: 10.1128/IAI.01176-06, PMID: 17101654, PMCID: PMC1828534 [dostęp 2021-03-09].
Bibliografia edytuj
- Adrian Lee, Francis Mégraud, Helicobacter pylori: techniques for clinical diagnosis & basic research, London: W.B. Saunders, 1996, ISBN 0-7020-2225-X.
Linki zewnętrzne edytuj
- W sprawie wytycznych Polskiego Towarzystwa Gastroenterologii dotyczących postępowania w zakażeniu Helicobacter pylori
- Informacje o Helicobacter pylori z Helicobacter Foundation (en)
- Martin J. Blaser, John C. Atherton, Helicobacter pylori persistence: biology and disease, „The Journal of Clinical Investigation”, 113 (3), 2004, s. 321–333, DOI: 10.1172/JCI20925, PMID: 14755326, PMCID: PMC324548 [dostęp 2021-03-09] (ang.).
- Harry L.T. Mobley, George L. Mendz, Stuart L. Hazell (red.), Helicobacter pylori. Physiology and genetics, Washington, DC: ASM Press, 2001, ISBN 978-1-68367-238-8, OCLC 64713601 [dostęp 2021-03-09].