Owrzodzenie Buruli
Owrzodzenie Buruli – endemicznie występująca bakteryjna choroba zakaźna, wywoływana przez prątki Mycobacterium ulcerans. Objawia się zazwyczaj najpierw jako niebolesny guzek, z czasem rozwijający się w ognisko martwicy skóry i tkanki podskórnej, drążące do głębszych tkanek. Choroba spotykana jest w Afryce, Azji, Ameryce Południowej i Australii. Mycobacterium ulcerans wydziela egzotoksynę, mykolakton, działającą jako aktywator apoptozy w komórkach ssaków.

Historia edytuj
Choroba i wywołujący ją patogen zostały opisane po raz pierwszy w 1948 roku przez Petera MacCalluma i wsp. u sześciu pacjentów z Bairnsdale w Australii[1][2][3][4][5]; w Australii wciąż spotyka się nazwę wrzodu Bairnsdale (Bairnsdale ulcer). Choroba była znana znacznie wcześniej w Afryce. W 1897 opisał ją brytyjski lekarz sir Albert Ruskin Cook, pracujący wtedy w szpitalu w Kampali w Ugandzie[6], a w latach 20. Kleinschmidt z Kongo[7].
Popularna nazwa pochodzi od rejonu Ugandy (dystrykt Buruli, obecnie dystrykt Nakasongola), gdzie w latach 60. odnotowano szczególnie wiele przypadków choroby.
Epidemiologia edytuj
Chorobę odnotowano w około trzydziestu krajach, głównie strefy tropikalnej i subtropikalnej[6]. Po gruźlicy i trądzie, jest trzecią najczęstszą chorobą wywoływaną przez mykobakterie[9].
Czynnikiem ryzyka jest praca w pobliżu zbiorników wodnych na terenach endemicznego występowania choroby. Szczególnie narażone są dzieci w wieku do 15 lat[6].
W Australii choroba występuje przede wszystkim w stanie Wiktoria i mieście Point Lonsdale. W kolejnych latach 2004, 2005 i 2006 odnotowano w Australii, odpowiednio, 25, 47 i 72 przypadki[6].
Etiologia edytuj
Czynnikiem wywołującym chorobę są prątki Mycobacterium ulcerans. Możliwe, że zarażenie odbywa się wskutek zakażenia ran skóry[10]. Doświadczalnie wykazano, że niektóre wodne pluskwiaki (z rodzin Naucoridae i Belostomatidae) mogą przenosić prątki w gruczołach ślinowych na zwierzęta[11][12].
Objawy i przebieg edytuj
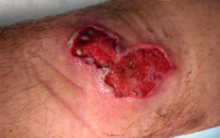
Pierwszym objawem zazwyczaj jest niebolesny, ruchomy względem skóry guzek. Choroba postępuje bez bólu i gorączki, doprowadzając do drążącego owrzodzenia o charakterystycznie uniesionych brzegach. Gojenie się owrzodzeń trwa miesiące i może prowadzić do przykurczy stawowych i powstawania bliznowców. Choroba rzadko prowadzi do zgonu[9].
Niekiedy pierwszym objawem choroby jest grudka (najczęściej u pacjentów z Australii), blaszka lub obrzęk[9].
Rozpoznanie edytuj
Rozpoznanie stawiane jest zazwyczaj na podstawie obrazu klinicznego. Z metod laboratoryjnych największą czułość mają metody genetyczne oparte na PCR. Barwienie metodą Ziehla-Neelsena ma czułość 40-80%, hodowla 20-60%. W wątpliwych przypadkach potwierdzenie infekcji może wymagać łączenia tych metod[13].
Hodowla jest możliwa na podłożach dla mykobakterii, jednak wymagana jest niższa temperatura inkubacji (29–33 °C)[6].
Rozpoznanie różnicowe edytuj
W diagnostyce różnicowej objawów klinicznych należy uwzględnić[6]:
- tropikalne owrzodzenia zgorzelinowe (ang. tropical phagedenic ulcers)
- leiszmaniozę
- guzki w przebiegu onchocerkozy
- zakażenia grzybicze skóry.
Leczenie edytuj
B) owrzodzenie palca środkowego cztery tygodnie później
C) opracowanie chirurgicznie po pięciu i pół tygodnia od początku objawów
D) wyleczona zmiana pięć miesięcy od początku objawów, miesiąc po autogenicznym przeszczepieniu skóry
W 2004 potwierdzono skuteczność niektórych antybiotyków wobec M. ulcerans; Światowa Organizacja Zdrowia (WHO) rekomenduje ośmiotygodniowe leczenie skojarzone ryfampycyną i streptomycyną przed ewentualną interwencją chirurgiczną[14].
Miejscowe zastosowanie temperatury 40 °C, po uprzednim usunięciu tkanek martwiczych, w przypadku niedużych owrzodzeń (o średnicy do 10 cm) skutkowało długoterminowym wyleczeniem. Metoda ta jest jednak zbyt niepraktyczna ze względu na wysoki koszt i częsty brak podstawowej infrastruktury w obszarach endemicznego występowania choroby[15].
Profilaktyka edytuj
Szczepionka BCG zapewnia krótkotrwałą odporność na M. ulcerans[10]. Badanie porównawcze przypadków przeprowadzone w południowym Beninie nie wykazało jednak skuteczności rutynowego szczepienia BCG w profilaktyce tej choroby[16].
Przypisy edytuj
- ↑ P. MacCallum. A new mycobacterial infection in man; clinical aspects. „J Pathol Bacteriol”. 60 (1), s. 93–102, Jan 1948. PMID: 18935206.
- ↑ G. Buckle, JC. Tolhurst. A new mycobacterial infection in man; cultivation of the new Mycobacterial infection in man; cultivation of the new Mycobacterium. „J Pathol Bacteriol”. 60 (1), s. 116–22, Jan 1948. PMID: 18876544.
- ↑ HA. Sissons. A new mycobacterial infection in man; pathology of the experimental lesions in the rat. „J Pathol Bacteriol”. 60 (1), s. 110–6, Jan 1948. PMID: 18876543.
- ↑ P. MacCallum, JC. Tolhurst. A new mycobacterial infection in man. „J Pathol Bacteriol”. 60 (1), s. 93–122, Jan 1948. PMID: 18876541.
- ↑ JC. Tolhurst, G. Buckle. A new mycobacterial infection in man; experimental investigations in laboratory animals. „J Pathol Bacteriol”. 60 (1), s. 102–10, Jan 1948. PMID: 18876542.
- ↑ a b c d e f WHO - Buruli ulcer disease. [dostęp 2009-11-22].
- ↑ Meyers WM. Mycobacterial infections of the skin. [w:] Seifert G, editor. Tropical dermatology. Heidelberg: Springer-Verlag 1994. Cytat za: Johnson, 2005
- ↑ PD. Johnson, T. Stinear, PL. Small, G. Pluschke i inni. Buruli ulcer (M. ulcerans infection): new insights, new hope for disease control. „PLoS Med”. 2 (4), s. e108, Apr 2005. DOI: 10.1371/journal.pmed.0020108. PMID: 15839744. PMCID: PMC1087202.
- ↑ a b c V. Sizaire, F. Nackers, E. Comte, F. Portaels. Mycobacterium ulcerans infection: control, diagnosis, and treatment. „Lancet Infect Dis”. 6 (5), s. 288-96, May 2006. DOI: 10.1016/S1473-3099(06)70464-9. PMID: 16631549.
- ↑ a b DS. Walsh, F. Portaels, WM. Meyers. Buruli ulcer (Mycobacterium ulcerans infection). „Trans R Soc Trop Med Hyg”. 102 (10), s. 969–78, Oct 2008. DOI: 10.1016/j.trstmh.2008.06.006. PMID: 18657836.
- ↑ F. Portaels, P. Elsen, A. Guimaraes-Peres, PA. Fonteyne i inni. Insects in the transmission of Mycobacterium ulcerans infection. „Lancet”. 353 (9157), s. 986, Mar 1999. DOI: 10.1016/S0140-6736(98)05177-0. PMID: 10459918.
- ↑ L. Marsollier, R. Robert, J. Aubry, JP. Saint André i inni. Aquatic insects as a vector for Mycobacterium ulcerans. „Appl Environ Microbiol”. 68 (9), s. 4623–8, Sep 2002. PMID: 12200321. PMCID: PMC124085.
- ↑ KH. Herbinger, O. Adjei, NY. Awua-Boateng, WA. Nienhuis i inni. Comparative study of the sensitivity of different diagnostic methods for the laboratory diagnosis of Buruli ulcer disease. „Clin Infect Dis”. 48 (8), s. 1055–64, Apr 2009. DOI: 10.1086/597398. PMID: 19275499.
- ↑ Buruli Ulcer. [dostęp 2009-11-22]. [zarchiwizowane z tego adresu (2009-10-09)].
- ↑ WM. Meyers, WM. Shelly, DH. Connor. Heat treatment of Mycobacterium ulcerans infections without surgical excision. „Am J Trop Med Hyg”. 23 (5), s. 924-9, Sep 1974. PMID: 4451233.
- ↑ F. Nackers, M. Dramaix, RC. Johnson, C. Zinsou i inni. BCG vaccine effectiveness against Buruli ulcer: a case-control study in Benin. „Am J Trop Med Hyg”. 75 (4), s. 768–74, Oct 2006. PMID: 17038709.