Rodzinna polipowatość gruczolakowata
Rodzinna polipowatość gruczolakowata (ang. familial adenomatous polyposis, FAP) – choroba genetyczna charakteryzująca się licznymi polipami gruczolakowatymi jelita grubego, powstającymi w 2. dekadzie życia. U nieleczonych chorych niemal we wszystkich przypadkach rozwija się rak jelita grubego.
| Adenomatous polyposis coli | |
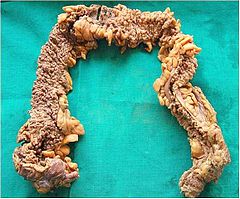 Liczne polipy w preparacie po kolektomii | |
| Klasyfikacje | |
| ICD-10 |
D12 |
|---|---|
| OMIM | |
| MeSH | |
Epidemiologia edytuj
Rodzinna polipowatość gruczolakowata to rzadka choroba. W 2009 roku Europejska Agencja Leków (EMEA, ang. European Medicines Agency) oszacowała jej częstość w populacji Unii Europejskiej na 3-10/100 000[1]. Jest traktowana jako stan przedrakowy, który nieuchronnie prowadzi do powstania raka jelita grubego. Zwykle nie ujawnia się przed 10. rokiem życia. Jej pełny obraz powstaje zwykle w 3. – 4. dekadzie życia. Tylko wyjątkowo objawy mogą się pojawić w okresie noworodkowym lub wczesnoniemowlęcym.
Etiologia edytuj
Choroba jest dziedziczona autosomalnie dominująco. FAP spowodowana jest mutacjami antyonkogenu APC (adenomatous poliposis coli gene) w locus 5q21-22. Mutacje te prowadzą do powstania nieprawidłowych, skróconych, białek. W około 25–30% przypadków mutacja ma charakter spontaniczny i u tych chorych wywiad rodzinny jest ujemny[2][3].
Patomorfologia edytuj
Charakterystyczne są polipy gruczolakowate, zarówno cewkowe, kosmkowe, jak i mieszane. Umiejscowione są na całej długości jelita, ze szczególnym uwzględnieniem esicy i odbytnicy. Z reguły nie przekraczają 1 cm. Makroskopowo mogą przypominać powiększone grudki chłonne okrężnicy, co może być przyczyną nierozpoznania choroby w badaniu kolonoskopowym.
Objawy i przebieg edytuj
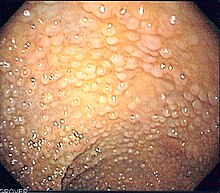
Głównym objawem są setki polipów gruczolakowatych różnej wielkości w okrężnicy i odbytnicy. U połowy pacjentów z FAP polipy są obecne w wieku 15 lat, a w wieku 35 lat u 95%[4]. Oprócz tego może współistnieć polipowatość dna żołądka (ang. fundic gland polyps, FGP), polipy dwunastnicy i gruczolaki jelita cienkiego.
Na podłożu gruczolaków rozwijają się nowotwory złośliwe. Najczęstszym nowotworem w zespole polipowatości gruczolakowatej jest rak jelita grubego, którego ryzyko wynosi niemal 100%[5]. U nieleczonych chorych rak jelita grubego powstaje przeciętnie w wieku 35 lat, a rzadko przed 20. rokiem życia[4].
Zespół powoduje powstawanie również innych nowotworów, z których najczęstszymi są rak brodawkowaty tarczycy i gruczolakorak jelita cienkiego.
Nowotwory złośliwe związane z FAP:
- rak tarczycy – najczęściej jest to rak brodawkowaty tarczycy, inne typy nowotworów złośliwych tarczycy są bardzo rzadkie[6], nowotwór w zespole FAP może występować z częstością od 0,6% do 6,1%[7][8]. Zalecany jest stały nadzór na chorymi[6].
- gruczolakorak jelita cienkiego – mnogie gruczolaki występują u 50–90% chorych, a u 3–5% chorych może rozwinąć się gruczolakorak[9]. Ryzyko nowotworu jest zwiększone 300-krotnie[10].
- hepatoblastoma – u dzieci z zespołem FAP występuje aż 750-7500 razy częściej niż w populacji ogólnej[11][6][12]. Mimo że skuteczność badań przesiewowych jest niejasna, niektórzy autorzy zalecają nadzór nad dziećmi z potwierdzonym zespołem[6][11][13].
- rak trzustki – zespół powoduje 4,5-krotny wzrost ryzyka zachorowania na ten typ nowotworu[7][14][6][15].
- rak żołądka – mimo że polipy w żołądku występują u połowy chorych[7][16], to ryzyko raka żołądka w krajach zachodnich jest bardzo niskie[17], znacznie wyższe występuje w krajach Azjatyckich, gdzie ryzyko może być nawet 10-krotnie wyższe niż w populacji ogólnej[7].
- rak nadnerczy – gruczolaki nadnerczy występują 4 razy częściej niż w populacji ogólnej, jednak przebieg kliniczny nie odbiega od przypadków nie uwarunkowanych zespołem, rak nadnerczy w zespole FAP występuje rzadko[6].
- guzy mózgu – najczęstszym guzem OUN związany z FAP jest rdzeniak, stanowi około 80% guzów związanych z zespołem FAP, ryzyko zachorowania w ciągu życia wynosi około 1%[7][6].
Choroba może dawać też zróżnicowane objawy pozajelitowe, takie jak[6]:
- kostniaki – występują u 20% chorych, zwykle w obrębie żuchwy i czaszki.
- nieprawidłowości uzębienia – występują u 17% chorych, nieprawidłowości obejmują zęby nadliczbowe, wrodzone braki zębów, torbiele zębowe, zębiaki,
- guzy desmoidalne – miejscowo złośliwy guz najczęściej zlokalizowany w jamie brzusznej, tylko 10% z nich znajduje się poza jamą brzuszną. Często rosną do ogromnych rozmiarów, stanowią duże zagrożenie dla sąsiednich struktur,
- torbiele epidermoidalne – nie wykazują potencjału złośliwego, stanowią problem kosmetyczny[7],
- wrodzona hipertrofia barwnikowa siatkówki.
Zespół Gardnera edytuj
Odmianą FAP jest zespół Gardnera, gdzie występowaniu setek, a nawet tysięcy polipów jelita grubego towarzyszy powstawanie guzów mezodermalnych o typie kostniaków, guzów desmoidalnych, torbieli naskórkowych oraz przerostu nabłonka barwnikowego siatkówki (CHRPE, ang. Congenital Hypertrophy of the Retinal Pigment Epithelium).
Zespół Turcota edytuj
Współwystępowanie guzów mózgu i polipów okrężnicy nazywamy zespołem Turcota.
Poronna postać FAP edytuj
Mniej agresywny wariant FAP określa się jako poronny (attenuated FAP, AFAP). W jego przebiegu powstaje mniej polipów (10-100), a polipy rozwijają się w późniejszym wieku[18]. Ryzyko nowotworu złośliwego jest mniejsze i nie przekracza 70%[4].
Rozpoznanie edytuj
Rozpoznanie FAP stawiane jest na podstawie badania kolonoskopowego.
Leczenie edytuj
Postępowaniem z wyboru jest leczenie operacyjne – najczęściej całkowita kolektomia. Istnieją próby leczenia profilaktycznego w postaci podawania niesteroidowych leków przeciwzapalnych, np. celekoksybu, sulindaku.
Klasyfikacja ICD10 edytuj
| kod ICD10 | nazwa choroby |
|---|---|
| ICD-10: D12 | Nowotwory niezłośliwe okrężnicy, odbytnicy, odbytu i kanału odbytu |
| ICD-10: D12.0 | Jelito ślepe |
| ICD-10: D12.1 | Wyrostek robaczkowy |
| ICD-10: D12.2 | Okrężnica wstępująca |
| ICD-10: D12.3 | Okrężnica poprzeczna |
| ICD-10: D12.4 | Okrężnica zstępująca |
| ICD-10: D12.5 | Okrężnica esowata |
| ICD-10: D12.6 | Okrężnica, nie określona |
| ICD-10: D12.7 | Zgięcie esiczo-odbytnicze |
| ICD-10: D12.8 | Odbytnica |
| ICD-10: D12.9 | Odbyt i kanał odbytu |
Przypisy edytuj
- ↑ Opinia Komitetu EMEA ds. Sierocych Produktów Leczniczych o kwalifikacji celekoksybu jako leku sierocego do leczenia FAP. (ang.).
- ↑ Bisgaard ML, Fenger K, Bülow S, Niebuhr E, Mohr J: Familial adenomatous polyposis (FAP): frequency, penetrance, and mutation rate. Hum Mutat 1994, 3:121–125.
- ↑ Rozen P, Samuel Z, Rabau M, Goldman G, Shomrat R, Legum C, Orr-Urtreger A: Familial adenomatous polyposis at the Tel Aviv Medical Center: demographic and clinical features. Fam Cancer 2001, 1:75–82.
- ↑ a b c M.L. Leoz, S. Carballal, L. Moreira, T. Ocaña i inni. The genetic basis of familial adenomatous polyposis and its implications for clinical practice and risk management. „Appl Clin Genet”. 8, s. 95–107, 2015. DOI: 10.2147/TACG.S51484. PMID: 25931827.
- ↑ F.G. Campos, M. Sulbaran, A.V. Safatle-Ribeiro, C.A. Martinez. Duodenal adenoma surveillance in patients with familial adenomatous polyposis. „World J Gastrointest Endosc”. 7 (10), s. 950–959, Aug 2015. DOI: 10.4253/wjge.v7.i10.950. PMID: 26265988.
- ↑ a b c d e f g h E.J. Groen, A. Roos, F.L. Muntinghe, R.H. Enting i inni. Extra-intestinal manifestations of familial adenomatous polyposis. „Ann Surg Oncol”. 15 (9), s. 2439–2450, Sep 2008. DOI: 10.1245/s10434-008-9981-3. PMID: 18612695.
- ↑ a b c d e f Kory W. Jasperson, Randall W. Burt, APC-Associated Polyposis Conditions, 1998.
- ↑ E. Steinhagen, J.G. Guillem, G. Chang, E.E. Salo-Mullen i inni. The prevalence of thyroid cancer and benign thyroid disease in patients with familial adenomatous polyposis may be higher than previously recognized. „Clin Colorectal Cancer”. 11 (4), s. 304–308, Dec 2012. DOI: 10.1016/j.clcc.2012.01.006. PMID: 22425061.
- ↑ M. Kadmon, A. Tandara, C. Herfarth. Duodenal adenomatosis in familial adenomatous polyposis coli. A review of the literature and results from the Heidelberg Polyposis Register. „Int J Colorectal Dis”. 16 (2), s. 63–75, Apr 2001. PMID: 11355321.
- ↑ B.V. Dasari, K.R. Gardiner. Management of adenocarcinoma of the small intestine. „Gastrointest Cancer Res”. 3 (3), s. 121–122, May 2009. PMID: 19626156.
- ↑ a b S. Aretz, A. Koch, S. Uhlhaas, W. Friedl i inni. Should children at risk for familial adenomatous polyposis be screened for hepatoblastoma and children with apparently sporadic hepatoblastoma be screened for APC germline mutations?. „Pediatr Blood Cancer”. 47 (6), s. 811–818, Nov 2006. DOI: 10.1002/pbc.20698. PMID: 16317745.
- ↑ L.J. Hughes, V.V. Michels. Risk of hepatoblastoma in familial adenomatous polyposis. „Am J Med Genet”. 43 (6), s. 1023–1025, Aug 1992. DOI: 10.1002/ajmg.1320430621. PMID: 1329510.
- ↑ R.P. Sanders, W.L. Furman. Familial adenomatous polyposis in two brothers with hepatoblastoma: implications for diagnosis and screening. „Pediatr Blood Cancer”. 47 (6), s. 851–854, Nov 2006. DOI: 10.1002/pbc.20556. PMID: 16106429.
- ↑ F.M. Giardiello, G.J. Offerhaus, D.H. Lee, A.J. Krush i inni. Increased risk of thyroid and pancreatic carcinoma in familial adenomatous polyposis. „Gut”. 34 (10), s. 1394–1396, Oct 1993. PMID: 8244108.
- ↑ F. Maire, P. Hammel, B. Terris, S. Olschwang i inni. Intraductal papillary and mucinous pancreatic tumour: a new extracolonic tumour in familial adenomatous polyposis. „Gut”. 51 (3), s. 446–449, Sep 2002. PMID: 12171972.
- ↑ G.J. Offerhaus, M.M. Entius, F.M. Giardiello. Upper gastrointestinal polyps in familial adenomatous polyposis. „Hepatogastroenterology”. 46 (26). s. 667–669. PMID: 10370594.
- ↑ S. Garrean, J. Hering, A. Saied, J. Jani i inni. Gastric adenocarcinoma arising from fundic gland polyps in a patient with familial adenomatous polyposis syndrome. „Am Surg”. 74 (1), s. 79–83, Jan 2008. PMID: 18274437.
- ↑ E. Half, D. Bercovich, P. Rozen. Familial adenomatous polyposis. „Orphanet J Rare Dis”. 4 (1), s. 22, Oct 2009. DOI: 10.1186/1750-1172-4-22. PMID: 19822006.