Zamek leucynowy
Zamek leucynowy (suwak leucynowy) – przestrzenny białkowy motyw strukturalny, łączący ze sobą białkowe helisy α. Zamki leucynowe stanowią często fragment białek wiążących DNA w różnych czynnikach transkrypcyjnych, a zatem biorą udział w regulacji ekspresji genów. Spotyka się je zarówno w prokariotycznych, jak i w eukariotycznych białkach regulatorowych, przy czym u tych drugich są spotykane częściej. Rodzina bZip czynników transkrypcyjnych oprócz zamka leucynowego zawiera region zasadowy, który poprzez wiązania wodorowe oddziałuje z większym rowkiem cząsteczki DNA.
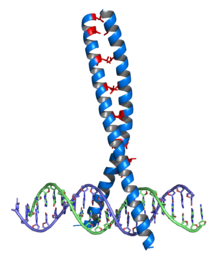
Zamek leucynowy pełni funkcję dimeryzacyjną równoległych helis α. Pojedynczy zamek leucynowy ma wiele reszt leucynowych, które w przybliżeniu występują co 7 reszt aminokwasowych. Układ ten tworzy amfifilową helisę alfa z regionem hydrofobowym po jednej stronie. Jest to miejsce, gdzie dochodzi do dimeryzacji, a oddziałujące reszty leucynowe przypominają ząbki zamka błyskawicznego, od czego pochodzi nazwa struktury.
Zamki leucynowe zostały pierwszy raz zidentyfikowane przez dopasowanie sekwencji czynników transkrypcyjnych wykazujących wspólną cechę występowania reszt leucynowych co 7 aminokwasów. Wykazano później, że leucyny te tworzą hydrofobowy rdzeń w wiązkach helis.