Efekt mezomeryczny
Efekt mezomeryczny zwany też efektem rezonansowym to w chemii zdolność grup funkcyjnych i ogólnie wszelkich podstawników do zmniejszania lub zwiększania reaktywności związków chemicznych na skutek nakładania się ich orbitali π lub p z orbitalami p lub π atomów, do których są one przyłączone[1].

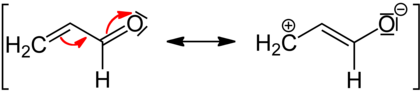
Zmniejszanie lub zwiększanie reaktywności związków, w których występuje efekt mezomeryczny, jest związane z wpływem na gęstość elektronową występującą na atomie, do którego jest przyłączona pojedynczym wiązaniem chemicznym dana grupa funkcyjna. Efekt ten jest też czasami obserwowany na atomach okolicznych. W formalnym zapisie mezomerię obrazuje się za pomocą struktur rezonansowych produktów przejściowych występujących w reakcjach chemicznych, w których ten efekt się objawia.
Efektu mezomerycznego nie należy mylić z efektem indukcyjnym podstawnika. Ten drugi wynika bezpośrednio z różnicy elektroujemności podstawnika i atomu, do którego jest on przyłączony. Efekt indukcyjny i mezomeryczny czasami wzajemnie się wspierają, a czasami są sobie przeciwstawne.
Idea efektu mezomerycznego została wprowadzona do terminologii chemicznej przez Christophera Kelka Ingolda w 1938 r. jako koncepcja alternatywna do idei rezonansu chemicznego, który zaproponował Linus Pauling[2]. W toku badań okazało się jednak, że na poziomie kwantowo-mechanicznym oba te efekty są w gruncie rzeczy tożsame, gdyż polegają na delokalizacji elektronów przez boczne nakładanie się na siebie orbitali π. Oba pojęcia można w zasadzie stosować zamiennie - przy czym o efekcie rezonansowym mówi się częściej w kontekście delokalizacji wiązań wielokrotnych występujących stale w związkach chemicznych, a o efekcie mezomerycznym w kontekście struktur tworzących się przejściowo w czasie reakcji chemicznych. Obecnie IUPAC zaleca stosowanie raczej pojęcia "rezonans chemiczny".
Efekt mezomeryczny może być dodatni (+M) lub ujemny (-M). Ujemny efekt ma miejsce wtedy, gdy podstawnik powoduje "wyciąganie" elektronów z reszty cząsteczki, czyli powoduje spadek gęstości elektronowej na atomie, do którego jest przyłączony. Dodatni efekt ma miejsce wtedy, gdy podstawnik "dostarcza" elektrony do reszty cząsteczki. Zarówno dodatni jak i ujemny efekt mezomeryczny może powodować zmniejszanie lub zwiększanie reaktywności związków chemicznych. Zależy to od mechanizmu danej reakcji. Do oceny siły efektu mezomerycznego stosowane są odpowiednie stałe takie jak stała rezonansowa Swaina-Luptona, stała rezonansowa Tafta czy też parametr pEDA Ozimińskiego i Dobrowolskiego.
Przykładowe podstawniki, które są +M w stosunku do atomu węgla sp3 w związkach organicznych:
- -O−
- -NH2
- -NR2
- -OH
- -OR
- -NHCOR
- -OCOR
- -(Aryl)
- -CH=CH-COOH
Przykładowe podstawniki, które są -M w stosunku do atomu węgla sp3 w związkach organicznych:
- -COOR
- -COOH
- -CHO
- -COR
- -CN
- -NO2
- -SO3H
- -NH3+
- -NR3+
Przypisy edytuj
- ↑ Definicja w IUPAC Gold Book. [dostęp 2007-06-07]. [zarchiwizowane z tego adresu (2009-02-19)].
- ↑ If It's Resonance, What Is Resonating? Kerber, Robert C. J. Chem. Educ. 2006 83 223. Abstract