Punkt potrójny
Punkt potrójny – stan, w jakim dana substancja może istnieć w trzech fazach termodynamicznych równocześnie w równowadze termodynamicznej[1]. Punkt ten określony jest przez temperaturę i ciśnienie punktu potrójnego. Na diagramie fazowym, ukazującym zależności ciśnienia od temperatury stanów równowagi faz, jest to punkt przecięcia krzywych równowagi fazowej substancji odpowiadający stanowi równowagi trwałej trzech stanów skupienia (ciało stałe, ciecz, gaz).

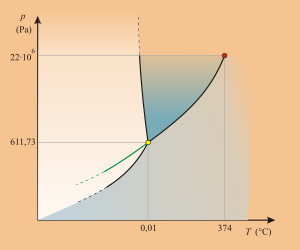
Punkt potrójny jest wielkością charakterystyczną dla danej substancji, podawany jest w opisach substancji. Punkty potrójne niektórych substancji są używane jako wzorce skali temperatur. Niektóre substancje nie mają punktu potrójnego, ponieważ nie występują we wszystkich trzech stanach skupienia. Przyczyną tego może być rozkład tych substancji w temperaturze mniejszej od temperatury przejścia fazowego, niezależnie od ciśnienia.
Punkt potrójny wody edytuj
Woda w stanie ciekłym, lód i para wodna są w równowadze (punkt potrójny) w temperaturze 0,01 °C (273,16 K) i ciśnieniu 611,73 Pa. Temperatura punktu potrójnego wody jest punktem odniesienia w definiowaniu termodynamicznych skal temperatur: Kelvina, Celsjusza i Rankine’a.
Temperatura punktu potrójnego wody wyznaczana przy swobodnym dostępie powietrza atmosferycznego wynosi 0 °C. Należy wówczas rozpatrywać nie ciśnienie, a prężność pary wodnej. Obniżenie temperatury jest spowodowane ciśnieniem atmosferycznym (o ok. 0,0075 °C) i rozpuszczaniem się gazów atmosferycznych w wodzie (dalsze 0,0025 °C)[2].
Diagram fazowy wody ma nietypowy przebieg. Zgodnie z równaniem Clausiusa ciepło przemiany fazowej można wyrazić wzorem
gdzie:
- – temperatura,
- – zmiana objętości podczas przemiany fazowej,
- – pochodna ciśnienia po temperaturze, określa zależność zmiany ciśnienia na skutek zmiany temperatury dla danego przejścia fazowego.
Pochodna ciśnienia po temperaturze odpowiada nachyleniu krzywej rozdziału faz, dokładniej jest równa tangensowi kąta nachylenia prostej stycznej do krzywej w danym punkcie. Dla krzywej rozdziału faz ciecz-ciało stałe wielkość ta ma zwykle wartość dodatnią (krzywa jest rosnąca). Jeżeli temperatura rośnie, substancja topnieje i pobiera ciepło Przy dodatniej wartości oznacza to, że również musi być dodatnie, czyli wzrasta objętość cieczy w stosunku do fazy stałej. W przypadku wody jest odwrotnie. Krzywa czyli zatem objętość podczas topnienia maleje.
Substancje wielofazowe edytuj
- Siarka w stanie stałym występuje w kilku odmianach alotropowych, dlatego ma kilka punktów potrójnych.
Zobacz też edytuj
- reguła faz Gibbsa
Przypisy edytuj
- ↑ punkt potrójny, [w:] Encyklopedia PWN [dostęp 2021-10-16].
- ↑ 24. Wykres charakterystyczny. W: Szczepan Szczeniowski: Fizyka doświadczalna. Wyd. I. Cz. II: Ciepło i fizyka molekularna. Warszawa: Państwowe Wydawnictwo Naukowe, 1953, s. 90.