Urządzenie wspomagające pracę komór serca
Urządzenie wspomagające pracę komór serca, urządzenie wspomagające czynność komór serca, VAD (z ang. ventricular assist device) – to jest elektromechaniczna, automatyczna pompa wspomagająca częściowo, lub przejmując całkowicie funkcję niewydolnej komory serca. Stosowane jest jako środek doraźny u chorych z niewydolnością serca (oczekujących na przeszczepienie lub u tych, u których przeszczepienie jest niemożliwe)[1][2]. VAD nie zastępuje komory serca, lecz wspomaga jego pracę (prawej lub lewej komory). Niektóre VAD są przeznaczone do krótkotrwałego stosowania, zazwyczaj dla pacjentów powracających do zdrowia po zawale mięśnia sercowego (ataku serca) i dla pacjentów powracających do zdrowia po operacji kardiochirurgicznej; niektóre są przeznaczone do długotrwałego stosowania (od miesięcy do lat)[3].

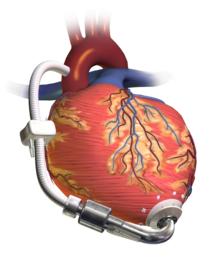
Zwykle długoterminowa VAD jest wykorzystywana jako pomost do przeszczepu serca) utrzymując pacjenta przy życiu i w dość dobrym stanie w czasie oczekiwania na przeszczep serca poza szpitalem, ale także u chorych z ostrą niewydolnością krążenia na czas umożliwiający poprawę funkcji serca[1][4].
Urządzenie może być montowane wewnątrz lub na zewnątrz ciała pacjenta. Napędzane jest elektrycznie (z baterii zewnętrznej) lub pneumatycznie[5].
VAD są zaprojektowane tak, aby wspomagać prawą komorę (RVAD) lub lewą komorę (LVAD) lub wspomagać obie komory (BiVAD). Rodzaj wszczepionego VAD zależy od rodzaju podstawowej choroby serca oraz od oporu w tętnicy płucnej, który determinuje obciążenie prawej komory. Urządzenie wspomagające lewą komorę (LVAD) jest najczęściej stosowanym urządzeniem do wadliwego serca (w większości przypadków wystarcza; prawa strona serca jest wtedy często w stanie wykorzystać znacznie zwiększony przepływ krwi), ale gdy opór w tętnicy płucnej jest wysoki, wtedy (dodatkowe) urządzenie wspomagające prawą komorę (RVAD) może być konieczne, aby rozwiązać problem krążenia w sercu. Jeśli potrzebny jest zarówno LVAD, jak i RVAD, zwykle stosuje się BiVAD, a nie oddzielne LVAD i RVAD[6].
Podczas pracy urządzenia wspomagającego lewą komorę serca krew pobierana jest z lewego przedsionka lub lewej komory i podawana jest do aorty. W przypadku niewydolności prawokomorowej VAD podłącza się do prawego przedsionka, z którego krew zasysana jest do RVAD i następnie podawana do tętnicy płucnej[7].
Pompy stosowane w przeszłości, najczęściej typu przeponowego lub workowatego, miały napęd pulsacyjny. Nowsze wersje używają pomp z wirnikami, co daje stały przepływ krwi i upraszcza sterowanie[5].
Historia edytuj
Pierwszy system wspomagania lewej komory (LVAD) został stworzony przez Domingo Liottę w Baylor College of Medicine w Houston w 1962. Pierwszy LVAD został wszczepiony w 1963 przez Liottę i E. Stanleya Crawforda. Pierwsza udana implantacja LVAD została przeprowadzona w 1966 przez Liottę wraz z dr Michaelem E. DeBakeyem. Pacjentka była 37-letnią kobietą, a urządzenie wspomagające (zewnętrzne) było w stanie zapewnić mechaniczne wsparcie przez 10 dni po operacji[8].
Pierwsze VAD wytwarzały przepływ pulsacyjny, w którym krew jest naprzemiennie zasysana do pompy z lewej komory, a następnie wtłaczana do aorty. Urządzenia tego rodzaju obejmują HeartMate IP LVAS, który został dopuszczony do użytku w USA przez Agencję Żywności i Leków (FDA) w październiku 1994. Urządzenia te zaczęły zdobywać popularność pod koniec lat 90. kiedy kardiochirurdzy zaczęli częściej wszczepiać je i pacjenci mogli mieszkać poza szpitalem w oczekiwaniu np. na przeszczep serca. Relacje medialne pacjentów ambulatoryjnych z VAD były bardzo pomocne w popularyzowaniu tej metody[9].
Późniejsze prace koncentrują się na pompach o przepływie ciągłym, które można z grubsza podzielić na pompy odśrodkowe lub pompy napędzane wirnikiem o przepływie osiowym. Zaletą tych pomp jest większa prostota, co skutkuje mniejszymi rozmiarami i większą niezawodnością. Urządzenia te są określane jako VAD drugiej generacji. Efektem ubocznym jest to, że użytkownik nie będzie miał tętna[19] lub że intensywność tętna zostanie poważnie zmniejszona[2][10].
VAD trzeciej generacji posiada wirnik w pompie zawieszony hydrodynamicznie lub elektromagnetycznie, eliminując w ten sposób potrzebę łożysk i zmniejszając liczbę ruchomych części do jednego.
W 2021 wszczepiono eksperymentalnie zwierzęciu (owca) LVAD CorWave nowej konstrukcji z zastosowaniem membrany umożliwiającej pulsacyjny przepływ krwi. Dotychczsowe wyniki są obiecujące[11].
Jednocześnie poddawane badaniom klinicznym jest zastosowanie przezskórnej indukcji do zasilania i sterowania urządzeniem zamiast używania kabli przezskórnych. Poza oczywistą korzyścią kosmetyczną zmniejsza to ryzyko infekcji i w konsekwencji konieczność podjęcia działań zapobiegawczych.
Wskazania do użycia edytuj
- we wstrząsie kardiogennym, po ustabilizowaniu którego w drugim etapie podejmowana jest decyzja odnośnie dalszego odpowiedniego leczenia[12]
- jako środek pomostowy do czasu przeszczepu serca (Bridge to Transplant)[12]
- jako strategia „pomostu do wyzdrowienia" (zachowania własnego serca) stała się postępowaniem z wyboru dla chorych w krytycznej fazie zapalenia mięśnia sercowego[12]
- jako terapia ostateczna u pacjentów, którzy nie kwalifikują się już do przeszczepu serca z powodu przeciwwskazań (np. nowotwory złośliwe, wiek, choroby współistniejące). W takim przypadku pacjent utrzymuje system do końca życia[12]
Przypisy edytuj
- ↑ a b WALDEMAR NOWAK. LVAD - pomost do przeszczepu lub wyleczenia niewydolności serca.. pulsmedycyny.pl. [dostęp 2022-10-18].
- ↑ a b Columbia Heart Surgery: Ventricular Assist Devices (VADS) And Mechanical Circulatory Support.. columbiasurgery.org. [dostęp 2022-10-18].
- ↑ Davorin Sef, Prashant Mohite, Fabio De Robertis, Alessandra Verzelloni Sef, Balakrishnan Mahesh, Ulrich Stock, Andre Simon. Bridge to heart transplantation using the Levitronix CentriMag short-term ventricular assist device. Artificial organs; 2020, 44, 9, pp. 1006-1008, doi:10.1111/aor.13709. PMID 32367538.. onlinelibrary.wiley.com. [dostęp 2022-10-18].
- ↑ Emma J. Birks, Patrick D. Tansley, James Hardy and all. Left Ventricular Assist Device and Drug Therapy for the Reversal of Heart Failure. N Engl J Med 2006; 355: pp. 1873-1884, doi:10.1056/NEJMoa053063.. www.nejm.org. [dostęp 2022-10-18].
- ↑ a b Religa (red.) 1993 ↓, s. 389.
- ↑ Religa (red.) 1993 ↓, s. 390.
- ↑ Religa (red.) 1993 ↓, s. 389-390.
- ↑ [https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3437761/ James K. Kirklin, David C. Naftel. Mechanical Circulatory Support: Registering a Therapy in Evolution. Circ Heart Fail. 2008; 1(3): 200–205. doi: 10.1161/CIRCHEARTFAILURE.108.782599.]. www.ncbi.nlm.nih.gov. [dostęp 2022-10-18].
- ↑ ELECTRIC HEART.. www.pbs.org. [dostęp 2022-10-18].
- ↑ No Pulse: How Doctors Reinvented The Human Heart.. www.popsci.com. [dostęp 2022-10-18].
- ↑ C.Botterbusch, N. Barabino, F. Cornat and all. Progress in the Development of the Pulsatile CorWave LVAD.J Heart and Lung Transplantation, 2021, 40, 4, Suppl. 4S; 355: pp. 1873-1884, doi:10.1056/NEJMoa053063.. www.jhltonline.org. [dostęp 2022-10-18].
- ↑ a b c d LVAD - Indikation. www.hdz-nrw.de. [dostęp 2023-02-08]. (niem.).
Bibliografia edytuj
- Choroby wewnętrzne. Przyczyny, rozpoznanie i leczenie. Andrzej Szczeklik (red.). T. I. Kraków: Wydawnictwo Medycyna Praktyczna, 2005, s. 331. ISBN 83-7430-031-0.
- Zbigniew Religa (red.), Zarys kardiochirurgii. W rozdz.: Krążenie wspomagane i sztuczne serce oraz ich zastosowanie w praktyce klinicznej - Walery I. Szumakow., wyd. I, Warszawa: Wydawnictwo Lekarskie PZWL, 1993, ISBN 83-200-1732-7.