Plastyd
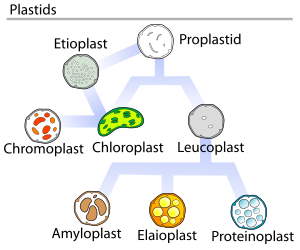
Plastyd – organellum otoczone dwiema błonami plastydowymi, występujące u roślin[1] oraz protistów roślinopodobnych. W komórkach embrionalnych występują proplastydy, z których rozwijają się pozostałe rodzaje plastydów[2]. Wnętrze plastydów wypełnione jest gęstym roztworem, stromą, zawierającym białka, DNA, związki rozpuszczalne oraz ziarna skrobi, plastoglobule oraz fitoferrytynę[1].

Zróżnicowanie i funkcje
edytujDo plastydów zaliczane są:
- Proplastydy posiadające słabo wykształconą lub niewykształconą strukturę wewnętrzną. Początkowo mają kształt kulisty, zmieniający się w trakcie rozwoju w elipsoidalny lub ameboidalny[1]. Podobne do analogicznych stadiów inicjalnych mitochondriów[3].
- Leukoplasty powstające głównie w komórkach bez dostępu światła, a jedynie wyjątkowo na świetle w organach nadziemnych. Ich główną funkcją jest przechowywanie materiałów zapasowych[1]. Do leukoplastów zaliczają się:
- elajoplasty, olejoplasty, lipidoplasty, magazynujące tłuszcze[4],
- amyloplasty magazynujące węglowodany – w postaci ziaren skrobi[4], uczestniczące w zjawisku geotropizmu statolity
- proteinoplasty, proteoplasty, magazynujące białka[5].
- Etioplasty, powstają z proplastydów w komórkach potencjalnie zdolnych do przeprowadzania fotosyntezy, gdy znajdują się one w ciemności. Podczas przekształcania proplastydy zwiększają swoje rozmiary z około 1 μm do 10 μm, wewnętrzna błona tworzy system regularnie ułożonych rurek, ciało prolamelarne, w którym zawarty jest protochlorofilid, bezpośredni prekursor chlorofilu[1].
- Chloroplasty, występujące w zielonych częściach roślin, odpowiedzialne za przeprowadzanie procesu fotosyntezy oraz wielu innych szlaków metabolicznych. Wewnętrzna błona chloroplastów wpukla się do wnętrza tworząc struktury nazywane tylakoidami[2]. Chloroplasty mogą powstawać z etioplastów oraz bezpośrednio z proplastydów, proces wykształcania chloroplastów wymaga dostępu światła[1].
- Chromoplasty, o żółtym, pomarańczowym lub czerwonym zabarwieniu pochodzącym od różnego typu karotenoidów. Występują w owocach, okwiecie oraz innych organach roślin, w tym organach spichrzowych[2]. Mogą powstawać zarówno z proplastydów, jak i leukoplastów, jednak zwykle powstają w wyniku przekształcenia chloroplastów[1].
- Gerontoplasty, powstające z chloroplastów w starzejących się komórkach liści. Podczas przekształcenia chloroplastów w gerontoplasty dochodzi do rozpadu błon tylakoidów. Odgrywają ważną funkcję w starzejących się komórkach, zapewniając demontaż aparatu fotosyntetycznego, w tym odzyskanie aminokwasów z białek chloroplastowych oraz bezpieczną degradację chlorofili[5].
Pochodzenie
edytujZgodnie z teorią endosymbiozy, opisaną przez Lynn Margulis, plastydy pochodzą od symbiotycznych bakterii, dlatego też: zachowały bakteryjne kształty i rozmiary, rozmnażają się w cytozolu niezależnie od podziałów komórki, nigdy nie występują w jądrze komórkowym, zachowały też własne, zubożone DNA podobne do DNA cyjanobakterii. Zanim potwierdzono podobieństwo DNA plastydowego do DNA bakterii, rozważano także koncepcję endogenicznego pochodzenia tych organelli przedstawioną przez Maxa Taylora, zakładającą powstanie plastydów bez udziału symbiozy, a poprzez odszczepienie się fragmentów jądra komórkowego[6].
Wyróżnia się trzy typy plastydów ze względu na pochodzenie. Pierwszą grupę stanowią plastydy roślin zielonych, drugą rodoplasty występujące u krasnorostów, a trzecią muroplasty, nazywane też cyjanelami występujące u glaukofitów[7][8][9]. Te trzy rodzaje plastydów są efektem pierwotnej endosymbiozy z bakteriami podobnymi do sinic. Plastydy pozostałych autotroficznych eukariotów są wynikiem wtórnej endosymbiozy[10].
Niektóre organizmy heterotroficzne mają zdolność do wchłonięcia plastydów ze zjadanych glonów. Plastydy takie, określane nazwą kleptoplastów, mogą przez kilka miesięcy przeprowadzać fotosyntezę i dostarczać związków organicznych. Utrzymanie funkcji plastydów pochodzących z glonów jest możliwe dzięki obecności genów niezbędnych do ich działania w genomie jądrowym organizmu heterotroficznego. Geny zostały przeniesione prawdopodobnie z wyniku poziomego transferu genów[11].
U większości organizmów zaliczanych do apikompleksów występują reliktowe plastydy określane jako apikoplasty. Organizmy te nabyły plastydy glonów w wyniku wtórnej endosymbiozy. Apikoplasty nie są zdolne do przeprowadzania fotosyntezy, jednak są niezbędne w metabolizmie posiadających je protistów[12].
Przypisy
edytuj- ↑ a b c d e f g Szweykowska Alicja, Szweykowski Jerzy: Botanika t.1 Morfologia. Warszawa: Wydawnictwo Naukowe PWN, 2003, s. 50-69. ISBN 83-01-13953-6.
- ↑ a b c Andrzej Tretyn: Podstawy strukturalno-funkcjonalne komórki roślinnej W: Fizjologia roślin (red. Kopcewicz Jan, Lewak Stanisław). Warszawa: Wydawnictwo Naukowe PWN, 2002, s. 22-88. ISBN 83-01-13753-3.
- ↑ J.L. Hall., T.J. Flowers, R.M. Roberts: Struktura i metabolizm komórek roślinnych. Warszawa: Państwowe Wydawnictwo Naukowe, 1982, s. 417-420. ISBN 83-01-03349-5.
- ↑ a b Cooper GM.: Chloroplasts and Other Plastids. W: The Cell: A Molecular Approach. Sunderland (MA): Sinauer Associates; 2000: 2000 2nd edition.
- ↑ a b Wise Robert R., Hoober J. Kenneth (red.): The Structure and Function of Plastids. New York Inc. Volume: 23: Springer-Verlag, 2007, s. 4-13, seria: Advances in Photosynthesis and Respiration. ISBN 978-1402065705.
- ↑ Lynn Margulis: Symbiotyczna planeta. Warszawa: Wydawnictwo CiS, 2000, s. 58-65. ISBN 83-85458-72-7.
- ↑ H. Nozaki, N. Ohta, M. Matsuzaki, O. Misumi i inni. Phylogeny of plastids based on cladistic analysis of gene loss inferred from complete plastid genome sequences.. „J Mol Evol”. 57 (4), s. 377-82, Oct 2003. DOI: 10.1007/s00239-003-2486-6. PMID: 14708571.
- ↑ F. Facchinelli, M. Pribil, U. Oster, NJ. Ebert i inni. Proteomic analysis of the Cyanophora paradoxa muroplast provides clues on early events in plastid endosymbiosis.. „Planta”, Dec 2012. DOI: 10.1007/s00425-012-1819-3. PMID: 23212214.
- ↑ JC. Hagopian, M. Reis, JP. Kitajima, D. Bhattacharya i inni. Comparative analysis of the complete plastid genome sequence of the red alga Gracilaria tenuistipitata var. liui provides insights into the evolution of rhodoplasts and their relationship to other plastids.. „J Mol Evol”. 59 (4), s. 464-77, Oct 2004. DOI: 10.1007/s00239-004-2638-3. PMID: 15638458.
- ↑ H. Nozaki, M. Matsuzaki, O. Misumi, H. Kuroiwa i inni. Cyanobacterial genes transmitted to the nucleus before divergence of red algae in the Chromista.. „J Mol Evol”. 59 (1), s. 103-13, Jul 2004. DOI: 10.1007/s00239-003-2611-1. PMID: 15383913.
- ↑ L. Pillet, J. Pawlowski. Transcriptome Analysis of Foraminiferan Elphidium margaritaceum Questions the Role of Gene Transfer in Kleptoplastidy.. „Mol Biol Evol”. 30 (1), s. 66-9, Jan 2013. DOI: 10.1093/molbev/mss226. PMID: 22993235.
- ↑ L. Lim, GI. McFadden. The evolution, metabolism and functions of the apicoplast.. „Philos Trans R Soc Lond B Biol Sci”. 365 (1541), s. 749-63, Mar 2010. DOI: 10.1098/rstb.2009.0273. PMID: 20124342.