Pyricularia oryzae
Pyricularia oryzae Cavara – gatunek grzybów workowych z klasy Sordariomycetes[1]. Wywołuje zarazę ryżu – najważniejszą grzybową chorobę roślin na świecie[2]. Jest organizmem modelowym do badania infekcji patogenów i interakcji między roślinami a grzybami[3]. P. oryzae jest pierwszym grzybem chorobotwórczym dla roślin, którego genom został zsekwencjonowany i powszechnie udostępniony[4].
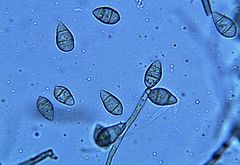 Strzępki i konidia pod mikroskopem | |
| Systematyka | |
| Domena | |
|---|---|
| Królestwo | |
| Typ | |
| Klasa | |
| Rząd | |
| Rodzina | |
| Rodzaj | |
| Gatunek |
Pyricularia oryzae |
| Nazwa systematyczna | |
| Pyricularia oryzae Cavara Fung. Long. Exsicc. 1: no. 49 (1892) | |

Systematyka edytuj
Pozycja w klasyfikacji według Index Fungorum: Pyricularia, Pyriculariaceae, Magnaporthales, Diaporthomycetidae, Sordariomycetes, Pezizomycotina, Ascomycota, Fungi[1].
- Dactylaria oryzae (Cavara) Sawada 1917
- Magnaporthe oryzae B.C. Couch 2002
- Pyricularia oryzae f. brachiariae P.G. Rao & D.K. Rao 1957
- Pyricularia oryzae f. rhynchelytri K.I. Wilson 1962
- Pyricularia oryzae f. stenotaphri K.I. Wilson & Preethamb. 1974
- Pyricularia oryzae var. commelinae Thirum., N.B. Kulk. & Patel 1956
- Pyricularia oryzae var. trachydis P.G. Rao & T.C.V. Reddy 1958
Charakterystyka edytuj
- Objawy porażenia: Na liściach i pędach ryżu pojawiają się plamy o barwie od białej do szarozielonej. Otoczone są ciemniejszymi obwódkami. Zwykle plamy mają długość 1,0-1,5 cm i szerokość 0,3-0,5 cm[2]. Starsze zmiany są eliptyczne lub wrzecionowate i białawe do szarych z nekrotycznymi brzegami. Uszkodzenia mogą się powiększać i łączyć powodując obumarcie liścia. Objawy obserwuje się na wszystkich nadziemnych częściach rośliny. Uszkodzenia można zobaczyć także pochwie liściowej, łodydze, węzłach łodygi i węźle szyjki wiechy. Infekcja węzłowa powoduje pęknięcie łodygi w zakażonym węźle (zgniła szyja). Wpływa również na rozmnażanie, powodując, że zakażona roślina produkuje mniej nasion. Straty plonu mogą sięgać nawet 80%[6].
- Cykl życiowy
- Początkowo grzyb ustanawia biotroficzny związek ze swoim gospodarzem. Atakuje kilka komórek, kradnie ich składniki odżywcze, ale nie zabija komórek. Ostatecznie jednak grzyb staje się nekrotroficzny, niszcząc tkankę roślinną. Zakażenie rozpoczyna się, gdy trójkomórkowe konidia patogenu przyklejają się do powierzchni żywiciela. Wytwarzany przez nie śluz pośredniczy w początkowym przyleganiu konidiów. Po wykiełkowaniu konidiów powstaje apressorium i strzępki infekcyjne, które przebijają ścianę komórkową. Do wnętrza komórek roślin wnikają one przez plazmodesmy. Po kolonizacji żywiciela i zakażeniu części nadziemnych powstają zmiany chorobowe i następuje konidiogeneza. Grzyb wytwarza nowe konidia, które rozprzestrzeniają się w powietrzu i wywołują infekcje wtórne, zapewniając ciągłość epidemii. Okresy między sezonami wegetacyjnymi roślin patogen może przetrwać w postaci przetrwalników, strzępek i konidiów wewnątrz resztek pożniwnych. Stanowią one źródło infekcji pierwotnej[2].
- Identyfikacja laboratoryjna
- Próbki z objawami porażenia umieszcza się w wilgotnej komorze w celu wywołania konidiogenezy. Przed obserwacją pod mikroskopem optycznym próbki inkubuje się przez 48 godzin w temperaturze pokojowej. Dodatkowo próbki można wysiewać na różne podłoża po powierzchniowej sterylizacji tkanki objawowej. Patogen hoduje się na pożywkach typu agar ziemniaczany (PDA – pożywka ogólna), mąka kukurydziana, słoma ryżowa i agar owsiany. Pożywki te sprzyjają zarodnikowaniu Pyricularia oryzae. Konidia są zwykle jasne, hialinowe lub lekko oliwkowo-zielone. Mają kształt gruszkowaty i posiadają dwie septy oraz wyrostek w podstawie. Konidiofory można zaobserwować wychodząc bezpośrednio z tkanki roślinnej zawierającej do 20 konidiów[2].
- Forma płciowa
- Etap płciowy (teleomorfę) zarazy ryżu można wytworzyć w laboratorium, jeśli sparuje się izolaty przeciwnego typu kojarzenia. W unitunikowych workach wytwarzane są wówczas szkliste, wrzecionowate ze zwężającymi się końcami askospory z trzema przegrodami. Uważa się, że grzyb ten jest heterotaliczny z dwubiegunowym systemem kojarzenia (kojarzenie kontrolowane przez dwa różne allele w jednym locus) z dodatkowymi genami kontrolującymi cykl płciowy[4].
Występowanie edytuj
Jest to gatunek kosmopolityczny występujący we wszystkich rejonach uprawy ryżu, zarówno na obszarach o klimacie tropikalnym, jak i klimacie umiarkowanym[2]. Jest uważany za najważniejszy grzybowy patogen roślin na świecie[7]. Ryż siewny (Oryza sativa) jest głównym żywicielem P. oryzae, ale patogen ten atakuje także proso i inne gatunki roślin z rodziny wiechlinowatych[2].
Nazwa i gatunki podobne edytuj
Zarazę ryżu wywołuje również Pyricularia grisea, który morfologicznie, zarówno makroskopowo, jak i mikroskopowo jest nie do odróżnienia od P. oryzae. Jak wykazała jednak analiza sekwencji nukleotydów DNA tych gatunków, różnią się one genetycznie i nie krzyżują się ze sobą[2]. W oparciu o najnowsze dane filogenetyczne, molekularne i morfologiczne, izolaty grzyba z ryżu i blisko spokrewnione izolaty z innych traw, takich jak Eragrostris curvula, manneczka łękowata (Eleusine coracana), życica trwała (Lolium perenne) i włośnica (Setaria spp.) są taksonomicznie opisane jako Pyricularia oryzae, podczas gdy izolaty z palusznika krwawego (Digitaria sanguinalis) są odrębne i powinny być opisane jako Pyricularia grisea[4].
Pyricularia oryzae to forma bezpłciowa (anamorfa). Istnieje także forma płciowa (teleomorfa), którą dawniej nazywano Magnaporthe oryzae. Ponieważ jednak zasadnicze znaczenie ma forma bezpłciowa, prawidłowe jest używanie nazwy Pyricularia oryzae[8], zaś Magnaporthe oryzae według Index Fungorum to jej synonim[5].
Przypisy edytuj
- ↑ a b Index Fungorum [online] [dostęp 2020-11-01] (ang.).
- ↑ a b c d e f g Tatiana Sanchez, Magnaporthe oryzae [online] [dostęp 2020-11-01] (ang.).
- ↑ Genome wide analysis of the transition to pathogenic lifestyles in Magnaporthales fungi [online], Scientifics reports [dostęp 2020-11-01] (ang.).
- ↑ a b c David O. TeBeest, Claudia Guerber, Michael Ditmore, Rice blast [online] [dostęp 2020-11-01] (ang.).
- ↑ a b Species Fungorum [online] [dostęp 2020-11-01] (ang.).
- ↑ Lynne Boddy, Pathogens of Autotrophs [online], The Fungi, 2016 [dostęp 2020-11-01] (ang.).
- ↑ Mansfield J, Genin S, Magori S, et al.. Top 10 plant pathogenic bacteria in molecular plant pathology. „Mol. Plant Pathol.”. 13 (6), s. 614–29, August 2012. DOI: 10.1111/j.1364-3703.2012.00804.x. PMID: 22672649. (ang.).
- ↑ Generic names in Magnaporthales [online] [dostęp 2020-11-01] (ang.).