Cykliczne (alkilo)(amino)karbeny
Cykliczne (alkilo)(amino)karbeny (CAACs, z ang. cyclic (alkylo)(amino)carbenes) – grupa organicznych związków chemicznych, będących stabilnymi singletowymi ligandami karbenowyymi. Zostały opracowane przez grupę badawczą Guya Bertranda w 2005 roku na Uniwersytecie Kalifornijskim w Riverside[1]. W przeciwieństwie do popularnych N‑heterocyklicznych karbenów (NHCs, ang. N‑heterocyclic carbenes), które posiadają dwa atomy azotu sąsiadujące z centrum karbenowym, CAACs posiadają jeden atom azotu oraz jeden atom węgla o hybrydyzacji sp3 (σ‑donorowy atom węgla w miejscu σ‑wyciągającego i π‑donorowego atomu azotu) połączone z karbenowym atomem węgla. Ta specyficzna konfiguracja sprawia, że CAACs są bardzo dobrymi σ‑donorami (wyższe HOMO) i π‑akceptorami (niższe LUMO) w porównaniu z NHCs[2]. Z uwagi na powyższe, CAACs są jednocześnie bardziej elektrofilowe i bardziej nukleofilowe niż NHCs[3].
Synteza
edytujPierwotne wytwarzanie prekursorów CAAC (Route 1)[4] rozpoczyna się od kondensacji 2,6‑diizopropyloaniliny z 2-metylopropanalem. Deprotonowanie tej iminy diizopropyloamidem litu daje anion aza-allilowy, którego pierścień otwiera 1,2-epoksy-2-metylopropan. Powstały alkoholan litu następnie traktuje się bezwodnikiem kwasu trifluorometanosulfonowego w celu wytworzenia soli aldyminowej. Ta ścieżka jest ograniczona dla niezatłoczonych czwartorzędowych atomów węgla[5][6]. Inne metody (Route 2) obejmują alkilowanie iminy za pomocą 3‑bromo-2-metylopropenu w celu wytworzenia alkenyloaldiminy, która podczas ogrzewania ulega cyklizacji do odpowiednich soli iminowych w obecności bezwodnego chlorowodoru (roztwór np. w dioksanie)[7][8][9]. Ta metoda pozwala na stosowanie bardziej zatłoczonych podstawników na czwartorzędowym atomie węgla pierścienia, natomiast ogranicza się jedynie do arylowych podstawników atomu azotu[10]. To proste podejście pozwala na syntezę prekursorów CAAC w skali kilogramowej. Na koniec deprotonowanie soli iminowych za pomocą bis(trimetylosililo)amidku potasu lub litu daje wolny karben w postaci białego ciała stałego. CAACs są wrażliwe na powietrze i wilgoć, ale można je przechowywać tygodniami w obojętnej atmosferze[11].
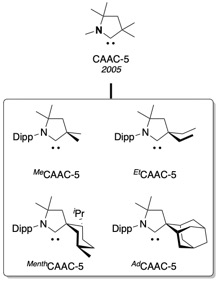
Nowe rodzaje cyklicznych (alkilo)(amino)karbenów
edytujOd 2005 roku rodzina cyklicznych (alkilo)(amino)karbenów jest stale rozszerzana i obejmuje funkcjonalizowane FunCAAC[12], BiCAAC z bicyklicznym szkieletem[13], CAAC‑6 z 6‑członowym szkieletem[14], i chiralne ChiCAAC stosowane w katalizie asymetrycznej[15].
Reakcje
edytujStwierdzono, że cykliczne (alkilo)(amino)karbeny jako ligandy zwiększają stabilność kompleksów[16][17][18][19][20]. Ich właściwości wynikające z bycia lepszymi σ‑donorami i π‑akceptorami niż dobrze znane N-heterocykliczne karbeny (NHCs)[21].
Κarbeny są wykorzystywane jako ligand katalizatorów metali przejściowych, np. kompleksy Ru–CAAC katalizują etenolizę[22]. Po raz pierwszy katalizatory metatezy rutenu wykazały tak wysoką wydajność w reakcjach metatezy krzyżowej z wykorzystaniem gazowego etylenu z aktywnością wystarczającą do produkcji na skalę przemysłową liniowych α‑olefin i innych produktów terminalnych olefin[23][24][25]. Kompleksy Ru–CAAC dzięki swojej dużej aktywności oraz stabilności wobec etenu, mogą być używane w bardzo niewielkich ilościach (< 10 ppm)[26], co może obniża koszty użycia ważne dla przemysłu (kompleksy rutenu są komercyjnie dostępne, ale bardzo drogie, np. 2 g kompleksu M720 kosztuje ok. 5 tys. zł[27]).
Wykazano również, że ambifilowy charakter CAACs pozwala im uczestniczyć w aktywacji silnych wiązań E−H (E: N, P, Si,…)[28], co jest charakterystyczne tradycyjnie dla kompleksów metali przejściowych. Zauważono, że silnie zatłoczone CAACs sprzyjają odwrotnej transformacji[29], reduktywnej eliminacji wiązań E−H przy węglu, co jest zbieżne z właściwościami metali przejściowych[30].
Przypisy
edytuj- ↑ Vincent Lavallo i inni, Stable Cyclic (Alkyl)(Amino)Carbenes as Rigid or Flexible, Bulky, Electron‐Rich Ligands for Transition‐Metal Catalysts: A Quaternary Carbon Atom Makes the Difference, „Angewandte Chemie International Edition”, 44 (35), 2005, s. 5705–5709, DOI: 10.1002/anie.200501841, PMID: 16059961, PMCID: PMC2427276 [dostęp 2024-07-10] (ang.).
- ↑ Mohand Melaimi, Michèle Soleilhavoup, Guy Bertrand, Stable Cyclic Carbenes and Related Species beyond Diaminocarbenes, „Angewandte Chemie International Edition”, 49 (47), 2010, s. 8810–8849, DOI: 10.1002/anie.201000165, PMID: 20836099, PMCID: PMC3130005 [dostęp 2024-07-10] (ang.).
- ↑ Jennifer Morvan i inni, Cyclic (Alkyl)(amino)carbenes (CAACs) in Ruthenium Olefin Metathesis, „ACS Catalysis”, 11 (3), 2021, s. 1714–1748, DOI: 10.1021/acscatal.0c05508 [dostęp 2024-07-10] (ang.).
- ↑ Vincent Lavallo i inni, Stable Cyclic (Alkyl)(Amino)Carbenes as Rigid or Flexible, Bulky, Electron‐Rich Ligands for Transition‐Metal Catalysts: A Quaternary Carbon Atom Makes the Difference, „Angewandte Chemie International Edition”, 44 (35), 2005, s. 5705–5709, DOI: 10.1002/anie.200501841, PMID: 16059961, PMCID: PMC2427276 [dostęp 2024-07-10] (ang.).
- ↑ Vincent Lavallo i inni, Stable Cyclic (Alkyl)(Amino)Carbenes as Rigid or Flexible, Bulky, Electron‐Rich Ligands for Transition‐Metal Catalysts: A Quaternary Carbon Atom Makes the Difference, „Angewandte Chemie International Edition”, 44 (35), 2005, s. 5705–5709, DOI: 10.1002/anie.200501841, PMID: 16059961, PMCID: PMC2427276 [dostęp 2024-07-10] (ang.).
- ↑ Debdeep Mandal i inni, Influence of N -Substitution on the Formation and Oxidation of NHC–CAAC-Derived Triazaalkenes, „Journal of Organic Chemistry”, 84 (14), 2019, s. 8899–8909, DOI: 10.1021/acs.joc.9b00774 [dostęp 2024-07-10] (ang.).
- ↑ Carsten Müller i inni, Synthesis, Structure, and Bonding Analysis of Tin(II) Dihalide and Cyclopentadienyltin(II) Halide (Alkyl)(amino)carbene Complexes, „Organometallics”, 38 (5), 2019, s. 1052–1061, DOI: 10.1021/acs.organomet.8b00861 [dostęp 2024-07-10] (ang.).
- ↑ Rodolphe Jazzar i inni, Intramolecular “Hydroiminiumation” of Alkenes: Application to the Synthesis of Conjugate Acids of Cyclic Alkyl Amino Carbenes (CAACs), „Angewandte Chemie International Edition”, 46 (16), 2007, s. 2899–2902, DOI: 10.1002/anie.200605083, PMID: 17352445, PMCID: PMC2440680 [dostęp 2024-07-10] (ang.).
- ↑ Rodolphe Jazzar i inni, Intramolecular “Hydroiminiumation and -amidiniumation” of Alkenes: A Convenient, Flexible, and Scalable Route to Cyclic Iminium and Imidazolinium Salts, „Journal of Organic Chemistry”, 72 (9), 2007, s. 3492–3499, DOI: 10.1021/jo0703909, PMID: 17408289, PMCID: PMC2440693 [dostęp 2024-07-10] (ang.).
- ↑ Eder Tomás-Mendivil i inni, Bicyclic (Alkyl)(amino)carbenes (BICAACs): Stable Carbenes More Ambiphilic than CAACs, „Journal of the American Chemical Society”, 139 (23), 2017, s. 7753–7756, DOI: 10.1021/jacs.7b04640 [dostęp 2024-07-10] (ang.).
- ↑ Vincent Lavallo i inni, Stable Cyclic (Alkyl)(Amino)Carbenes as Rigid or Flexible, Bulky, Electron‐Rich Ligands for Transition‐Metal Catalysts: A Quaternary Carbon Atom Makes the Difference, „Angewandte Chemie International Edition”, 44 (35), 2005, s. 5705–5709, DOI: 10.1002/anie.200501841, PMID: 16059961, PMCID: PMC2427276 [dostęp 2024-07-10] (ang.).
- ↑ Jiaxiang Chu i inni, Synthesis of Hemilabile Cyclic (Alkyl)(amino)carbenes (CAACs) and Applications in Organometallic Chemistry, „Journal of the American Chemical Society”, 138 (25), 2016, s. 7884–7887, DOI: 10.1021/jacs.6b05221 [dostęp 2024-07-10] (ang.).
- ↑ Eder Tomás-Mendivil i inni, Bicyclic (Alkyl)(amino)carbenes (BICAACs): Stable Carbenes More Ambiphilic than CAACs, „Journal of the American Chemical Society”, 139 (23), 2017, s. 7753–7756, DOI: 10.1021/jacs.7b04640 [dostęp 2024-07-10] (ang.).
- ↑ Cory M. Weinstein i inni, Highly Ambiphilic Room Temperature Stable Six-Membered Cyclic (Alkyl)(amino)carbenes, „Journal of the American Chemical Society”, 140 (29), 2018, s. 9255–9260, DOI: 10.1021/jacs.8b05518 [dostęp 2024-07-10] (ang.).
- ↑ Delphine Pichon i inni, The debut of chiral cyclic (alkyl)(amino)carbenes (CAACs) in enantioselective catalysis, „Chemical Science”, 10 (33), 2019, s. 7807–7811, DOI: 10.1039/C9SC02810B, PMID: 31588330, PMCID: PMC6761915 [dostęp 2024-07-10] (ang.).
- ↑ Michèle Soleilhavoup, Guy Bertrand, Cyclic (Alkyl)(Amino)Carbenes (CAACs): Stable Carbenes on the Rise, „Accounts of Chemical Research”, 48 (2), 2015, s. 256–266, DOI: 10.1021/ar5003494 [dostęp 2024-07-10] (ang.).
- ↑ Mohand Melaimi i inni, Cyclic (Alkyl)(amino)carbenes (CAACs): Recent Developments, „Angewandte Chemie International Edition”, 56 (34), 2017, s. 10046–10068, DOI: 10.1002/anie.201702148 [dostęp 2024-07-10] (ang.).
- ↑ Sudipta Roy, Kartik Chandra Mondal, Herbert W. Roesky, Cyclic Alkyl(amino) Carbene Stabilized Complexes with Low Coordinate Metals of Enduring Nature, „Accounts of Chemical Research”, 49 (3), 2016, s. 357–369, DOI: 10.1021/acs.accounts.5b00381 [dostęp 2024-07-10] (ang.).
- ↑ Subrata Kundu i inni, Stable cyclic (alkyl)(amino)carbene (cAAC) radicals with main group substituents, „Chemical Science”, 10 (18), 2019, s. 4727–4741, DOI: 10.1039/C9SC01351B, PMID: 31160949, PMCID: PMC6510188 [dostęp 2024-07-10] (ang.).
- ↑ Tobias Ullrich i inni, Singlet Fission in Carbene‐Derived Diradicaloids, „Angewandte Chemie International Edition”, 59 (20), 2020, s. 7906–7914, DOI: 10.1002/anie.202001286, PMID: 32129920, PMCID: PMC7317569 [dostęp 2024-07-10] (ang.).
- ↑ Delphine Pichon i inni, The debut of chiral cyclic (alkyl)(amino)carbenes (CAACs) in enantioselective catalysis, „Chemical Science”, 10 (33), 2019, s. 7807–7811, DOI: 10.1039/C9SC02810B, PMID: 31588330, PMCID: PMC6761915 [dostęp 2024-07-10] (ang.).
- ↑ Vanessa M. Marx i inni, Cyclic Alkyl Amino Carbene (CAAC) Ruthenium Complexes as Remarkably Active Catalysts for Ethenolysis, „Angewandte Chemie International Edition”, 54 (6), 2015, s. 1919–1923, DOI: 10.1002/anie.201410797, PMID: 25522160, PMCID: PMC4713124 [dostęp 2024-07-10] (ang.).
- ↑ Dawei Di i inni, High-performance light-emitting diodes based on carbene-metal-amides, „Science”, 356 (6334), 2017, s. 159–163, DOI: 10.1126/science.aah4345, PMID: 28360136, arXiv:1606.08868 [dostęp 2024-07-10] (ang.).
- ↑ Rasha Hamze i inni, Eliminating nonradiative decay in Cu(I) emitters: >99% quantum efficiency and microsecond lifetime, „Science”, 363 (6427), 2019, s. 601–606, DOI: 10.1126/science.aav2865 [dostęp 2024-07-10] (ang.).
- ↑ Rodolphe Jazzar, Michele Soleilhavoup, Guy Bertrand, Cyclic (Alkyl)- and (Aryl)-(amino)carbene Coinage Metal Complexes and Their Applications, „Chemical Reviews”, 120 (9), 2020, s. 4141–4168, DOI: 10.1021/acs.chemrev.0c00043 [dostęp 2024-07-10] (ang.).
- ↑ Adrian Sytniczuk i inni, A tunable family of CAAC-ruthenium olefin metathesis catalysts modularly derived from a large-scale produced ibuprofen intermediate, „Chemical Science”, 14 (39), 2023, s. 10744–10755, DOI: 10.1039/D3SC03849A, PMID: 37829018, PMCID: PMC10566500 [dostęp 2024-07-10] (ang.).
- ↑ Strona Merck Polska [online], Prezentacja dostępności i kosztów kompleksów rutenowych [dostęp 2024-07-03].
- ↑ Guido D. Frey i inni, Facile Splitting of Hydrogen and Ammonia by Nucleophilic Activation at a Single Carbon Center, „Science”, 316 (5823), 2007, s. 439–441, DOI: 10.1126/science.1141474 [dostęp 2024-07-10] (ang.).
- ↑ Daniel R. Tolentino i inni, Reductive Elimination at Carbon under Steric Control, „Journal of the American Chemical Society”, 141 (25), 2019, s. 9823–9826, DOI: 10.1021/jacs.9b04957 [dostęp 2024-07-10] (ang.).
- ↑ Piet W.N.M. van Leeuwen, Catalysis, Homogeneous, [w:] Robert A. Meyers (red.), Encyclopedia of Physical Science and Technology, wyd. 3, New York: Academic Press, 2003, s. 457–490, DOI: 10.1016/b0-12-227410-5/00085-5, ISBN 978-0-12-227410-7 [dostęp 2024-07-03] (ang.).