Karbonylki
Karbonylki – nieorganiczne związki kompleksowe, w których ligandem jest tlenek węgla, stosowane w chemii metaloorganicznej. Nazwę karbonylek stosuje się także na określenie samego ligandu karbonylkowego, CO (nie należy mylić go z organiczną grupą karbonylową).
Pierwszy związek zawierający ligandy karbonylkowe został otrzymany przez Ludwiga Monda w 1888 r. Zauważył on, że tlenek węgla reaguje z niklem, tworząc związek o zadziwiająco niskiej temperaturze wrzenia (43 °C)[1][2], który po podgrzaniu do ok. 100 °C rozkłada się ponownie do niklu i tlenku węgla:
Po kilku latach badań Mond zastosował proces syntezy, destylacji i rozkładu termicznego tetrakarbonylku niklu do otrzymywania bardzo czystego niklu w swojej hucie w Walii. Proces ten do dziś jest z powodzeniem stosowany przy produkcji tego metalu. Wkrótce potem Mond, a także – niezależnie od niego – Bertholet, otrzymali w podobny sposób Fe(CO)5. natomiast karbonylki innych metali najlepiej jest otrzymywać w reakcji ich soli z CO w warunkach redukujących[3].
Tlenek węgla ma wolną parę elektronową na atomie węgla i jest w związku z tym słabą zasadą Lewisa. Słabe zasady Lewisa zwykle nie reagują z metalami na zerowym stopniu utlenienia. Jednak wiązanie M−CO jest stabilizowane przez szczególny układ orbitali molekularnych[4]:
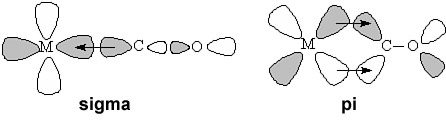
Wiązanie σ jest wiązaniem koordynacyjnym, w którym funkcję donora elektronów pełni karbonylek – samo w sobie jest ono jednak energetycznie niekorzystne i, jak dowodzą obliczenia kwantowo-mechaniczne, jest ono właściwie lekko antywiążące. Cały układ jest dopiero stabilizowany przez wiązania π między orbitalami sp tlenku węgla i orbitalami d metalu, przy czym rolę donora elektronów odgrywa tu metal, a nie karbonylek (jest to przykład tak zwanego „wiązania zwrotnego”)[4].
Wiązanie metal-karbonylek jest jednak względnie słabe. Ligand karbonylkowy można bardzo łatwo oderwać od metalu – dzięki czemu łatwo wymienia się go na inne ligandy (L')[5]:
Dość łatwo można też wyeliminować jeden lub więcej ligandów karbonylkowych i otrzymać bardzo stabilne aniony o wysokiej zasadowości[5]:
Z kolei aniony te są czynnikami nukleofilowymi, z których można otrzymać wodorki karbonylkowe[5]:
- Na+
[HFe(CO)
4]−
+ HX → H
2Fe(CO)
4 + NaX
które są kwasami protonowymi, o zróżnicowanej mocy (np.: HCo(CO)
4 ma pKa = 1), przy czym atom wodoru jest w nich ligandem atomu centralnego i może zostać wymieniony na inny ligand, np.[potrzebny przypis]:
Labilne własności karbonylków metali, połączone z łatwością ich syntezy, są one bardzo często podstawowym, wyjściowym substratem do otrzymywania wielu związków metaloorganicznych. Łatwość zrywania i tworzenia wiązań metal-karbonylek jest też bardzo przydatna w katalizie i dlatego ogromna większość katalizatorów metaloorganicznych zawiera zwykle przynajmniej jeden ligand tego rodzaju – kompleksy czysto karbonylkowe są jednak zbyt reaktywne, aby same pełnić tę rolę. Wyjątek stanowi Fe
2(CO)
9, który był stosowany w latach 1925–1945 jako dodatek przeciwstukowy do benzyny w Niemczech i krajach okupowanych przez Niemcy w czasach II wojny światowej[potrzebny przypis].
Przypisy
edytuj- ↑ Bochmann 1996 ↓, s. 8.
- ↑ Maryadele J. O'Neil i inni red., The Merck Index - An Encyclopedia of Chemicals, Drugs, and Biologicals. Whitehouse Station, Merck and Co., Inc., 1996, s. 1117.
- ↑ Bochmann 1996 ↓, s. 8–9.
- ↑ a b Bochmann 1996 ↓, s. 10–11.
- ↑ a b c Bochmann 1996 ↓, s. 15–16.
Bibliografia
edytuj- Manfred Bochmann, Organometallics. 1: Complexes with transition metal-carbon delta-bonds, Oxford: Oxford University Press, 1996, ISBN 978-0-19-855750-0 [dostęp 2023-07-17].

