Reakcja biuretowa
Reakcja biuretowa (reakcja Piotrowskiego[1]) – charakterystyczna reakcja chemiczna pozwalająca na wykrywanie wiązań peptydowych w rozmaitych związkach organicznych, głównie w białkach i peptydach. Warunkiem koniecznym dla pozytywnego wyniku próby jest występowanie co najmniej dwóch wiązań peptydowych bezpośrednio obok siebie lub przedzielonych nie więcej niż jednym atomem węgla. Nazwa testu pochodzi od najprostszego związku, który ulega tej reakcji, a mianowicie biuretu, czyli dimeru mocznika (NH2CONHCONH2)[2].

Historia
edytujReakcja biuretowa została opisana po raz pierwszy w roku 1833 przez Ferdinanda Rosego[3]. W roku 1857 opisał ją niezależnie polski fizjolog Gustaw Piotrowski[4] i od jego nazwiska pochodzą alternatywne nazwy testu, reakcja Piotrowskiego lub odczyn Piotrowskiego[5].
Opis testu
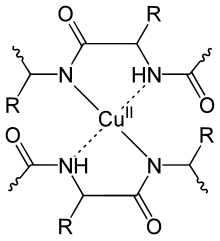
edytujTest biuretowy polega na dodaniu do analizowanej mieszaniny roztworu silnej zasady (NaOH lub KOH) oraz siarczanu miedzi(II). Jeżeli w roztworze obecne są związki zawierające bliskie wiązania peptydowe, to roztwór zmienia barwę z niebieskiej na fioletową (λmax = 505 nm). Jest to spowodowane powstawaniem anionowych związków kompleksowych[2], w których jon Cu2+ jest kompleksowany przez minimum dwie grupy peptydowe. W przypadku reakcji biuretu z miedzią(II), wyizolowano krystaliczny kompleks K2[Cu(NHCONHCONH)2]·4H2O i rentgenograficznie ustalono jego dokładną budowę[2].
Uznany podręcznik chemii klinicznej, Fundamental laboratory approaches for biochemistry and biotechnology[6], podaje, że oznaczanie peptydów można przeprowadzać w próbkach zawierających wolne aminokwasy – mają mały wpływ na wynik, gdyż nie zawierają wiązania peptydowego[7]. Zarówno wolne aminokwasy, jak i dipeptydy (w których występuje tylko jedno wiązanie peptydowe), powodują powstanie kompleksu z jonami miedzi o zabarwieniu niebieskim. Dlatego test daje pozytywny wynik dla co najmniej tripeptydów[8]. Dokładniejsze badania wskazują jednak, że aminokwasy i dipeptydy, a także mocznik, kreatynina i inne związki niskocząsteczkowe mogą prowadzić do znaczącego zawyżenia wyniku przy oznaczaniu peptydów i białek[6].
Test może być stosowany zarówno w analizie jakościowej, jak i ilościowej. W tym drugim przypadku wykorzystuje się liniową zależność zmiany barwy od stężenia protein, a ściślej biorąc od liczby podwójnych wiązań peptydowych, którą ustala się kolorymetrycznie oraz stosuje odczynnik biuretowy, np: 7,5 g CuSO4·5H2O, 100 ml 50% NaOH, 25 g winianu sodowo-potasowego oraz taka objętość wody aby uzyskać 1 dm3 roztworu.
Zastosowanie w medycynie
edytujTest ten jest stosowany do sprawdzania obecności wolnego białka w moczu człowieka. Występowanie dużych ilości takiego białka wskazuje zwykle na uszkodzenia organów wewnętrznych, np. na marskość wątroby[9][10].
Ograniczeniem testu jest jego dość niska czułość[7].
Przypisy
edytuj- ↑ Charles William Hale, Domestic Science, Cambridge: Cambridge University Press, 1915 (Cambridge Technical Series), s. 229 [dostęp 2021-04-21].
- ↑ a b c H.C. Freeman, J.E.W.L. Smith, J.C. Taylor, Crystallographic studies of the biuret reaction. I. Potassium bis-biuret cuprate(II) tetrahydrate, K2[Cu(NHCONHCONH)2]·4H2O, „Acta Crystallographica”, 14 (4), 1961, s. 407–418, DOI: 10.1107/S0365110X61001339 [dostęp 2021-04-21] (ang.).
- ↑ Ferdinand Rose, Ueber die Verbindungen des Eiweiss mit Metalloxyden, „Annalen der Physik und Chemie”, 104 (5), 1833, s. 132–142, DOI: 10.1002/andp.18331040512 [dostęp 2021-04-21] (niem.).
- ↑ G. von Piotrowski, Eine neue Reaction auf Eiweisskörper und ihre näheren Abkömmlinge, „Sitzungsberichte der Kaiserlichen Akademie der Wissenschaften. Mathematisch-Naturwissenschaftliche Classe”, 24, 1857, s. 335-337 [dostęp 2021-04-21] (niem.).
- ↑ Maciej Iłowiecki, Dzieje nauki polskiej, Warszawa: Interpress, 1981, s. 175, ISBN 83-223-1876-6.
- ↑ a b Glen L. Hortin, Bonnie Meilinger, Cross-reactivity of amino acids and other compounds in the biuret reaction: interference with urinary peptide measurements, „Clinical Chemistry”, 51 (8), 2005, s. 1411–1419, DOI: 10.1373/clinchem.2005.052019, PMID: 15951313 [dostęp 2021-04-21].
- ↑ a b Quantification of Protein Concentration, [w:] Alexander J. Ninfa, David P. Ballou, Marilee Benore, Fundamental laboratory approaches for biochemistry and biotechnology, wyd. 2, Hoboken, NJ: John Wiley, 2010, s. 111, ISBN 978-0-470-08766-4, OCLC 420027217 [dostęp 2021-04-21] (ang.).
- ↑ Christopher J. Fenk, Nathan Kaufman, Donald G. Gerbig, A New Colorimetric Assay of Tabletop Sweeteners Using a Modified Biuret Reagent, „Journal of Chemical Education”, 84 (10), 2007, s. 1676, DOI: 10.1021/ed084p1676 [dostęp 2021-04-21] (ang.).
- ↑ Xu Guobing i inni, Application of an improved biuret method to the determination of total protein in urine and cerebrospinal fluid without concentration step by use of Hitachi 7170 auto‐analyzer, „Journal of Clinical Laboratory Analysis”, 15 (4), 2001, s. 161–164, DOI: 10.1002/jcla.1020, ISSN 0887-8013, PMID: 11436195, PMCID: PMC6807869 [dostęp 2021-03-13].
- ↑ Roger L. Bertholf, Proteins and Albumin, „Laboratory Medicine”, 45 (1), 2014, e25–e41, DOI: 10.1309/LMKRNRGW5J03APZQ, ISSN 0007-5027 [dostęp 2021-03-13] (ang.).