Wspólny pień tętniczy
Wspólny pień tętniczy (ang. persistent truncus arteriosus, PTA) – rzadka (ok. 1%) wada serca polegająca na odchodzeniu od serca pojedynczego naczynia tętniczego, w którym płynie krew do krążenia systemowego, wieńcowego i płucnego. Wada powstaje w wyniku przetrwania pierwotnego pnia tętniczego w czasie rozwoju zarodka na skutek nie wytworzenia się przegrody aortalno-płucnej. Z komór serca znad dużego ubytku międzykomorowego (VSD) odchodzi jedno wspólne naczynie w formie wspólnego pnia tętniczego, które następnie rozdziela się na aortę i tętnice płucne. Zastawka aortalna w tym wypadku nazywana jest zastawką wspólnego pnia i często jest nieprawidłowo wykształcona. Dochodzi do ciągłego mieszania się krwi utlenowanej z nieutlenowaną, która zaopatruje tętnice wieńcowe, tętnice płucne i krążenie systemowe. Wada jest zaliczana do wad wczesnosiniczych. Chorzy, którzy nie są leczeni we wczesnym okresie po urodzeniu rzadko przeżywają do okresu dorosłości[1][2][3][4].
| Truncus arteriosus communis | |
 Schematyczny obraz wspólnego pnia tętniczego | |
| Klasyfikacje | |
| ICD-10 |
Q20.0 |
|---|---|
Wada po raz pierwszy została zauważona podczas autopsji w 1798 przez Wilsona[5]. Anatomiczne szczegóły zostały opisane w latach późniejszych przez Buchanana[6].
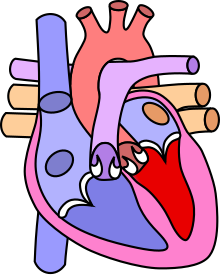
Klasyfikacja
edytujNajbardziej znaną klasyfikacją jest system opracowany przez Collett i Edwards w 1947[7]:
- Typ I: pień płucny odchodzi od wspólnego pnia tętniczego, następnie rozdziela się na dwie tętnice płucne
- Typ II: tętnice płucne odchodzą bezpośrednio od pnia tętniczego blisko siebie – powstają dwie tylne lub tylno boczne tętnice płucne
- Typ III: tętnice płucne odchodzą bezpośrednio od pnia tętniczego w pewnym oddaleniu od siebie – powstają dwie boczne tętnice płucne
- Typ IV: nie spełnia embriologicznych kryteriów tej wady, jest w rzeczywistości atrezją tętnicy płucnej. Obecnie ten typ klasyfikowany jest przez większość źródeł jako najcięższa postać zespołu Fallota ze skrajną hipoplazją tętnicy płucnej[1]
Zmiany anatomiczne
edytuj- jedna, wspólna tętnica odchodzi z prawej i lewej komory
- zaburzenia w zastawce pnia płucnego
- prawostronne odejście łuku aorty w około 30% przypadków
- duży ubytek przegrody międzykomorowej
- mieszanie się krwi na poziomie dużych naczyń
- nadciśnienie płucne
Objawy
edytujRozpoznanie
edytuj- rtg klatki piersiowej
- badanie ekg
- badanie echokardiograficzne
- przed zabiegiem operacyjnym wskazane jest wykonanie cewnikowania serca w celu szczegółowego określenia współistniejących anomalii
Leczenie
edytujNajczęściej chorzy od urodzenia wymagają leczenia niewydolności krążenia diuretykami, digoksyną i inhibitorami ACE w celu przygotowania ich do leczenia operacyjnego[1].
Leczenie wady jest wyłącznie chirurgiczne, które polega na rekonstrukcji odpływu systemowego i płucnego. VSD zamykane jest łatą z tworzywa sztucznego z zapewnieniem wyrzutu krwi z lewej komory serca do wspólnego pnia tętniczego. Wcześniejsza operacja chroni krążenie płucne przed powstaniem nadciśnienia w krążeniu małym i przed niewydolnością serca. Lepsze wyniki osiąga się dzięki naprawie zastawki wspólnego pnia, niż przy jej wymianie[1][8].
Operacja wykonywana jest w krążeniu pozaustrojowym w hipotermii ok. 20 °C często z krótkotrwałym zatrzymaniem krążenia. Po otworzeniu serca zamyka się VSD łatą ze sztucznego tworzywa (dakron). Po odseparowaniu naczyń płucnych od wspólnego pnia zamyka się otór (otwory) po ich usunięciu. Następnie rekonstruuje się ciągłość między prawą komorą serca a naczyniami płucnymi z użyciem homograftu, heterograftu (proteza naczyniowa z zastawką lub bez) lub heterograftu biologicznego (np. proteza zastawkowa Contegra®)[1][9][10][11].
Pacjenci po operacyjnym leczeniu wymagają okresowej kontroli kardiologicznej, ponieważ w późniejszym okresie mogą wystąpić zaburzenia w zakresie zastawki aortalnej, wraz ze wzrostem pacjentów homografty wymagają też wymiany na nowe o większej średnicy[9][10].
U wszystkich pacjentów konieczna jest profilaktyka bakteryjnego zapalenia wsierdzia przed zabiegami stomatologicznymi lub chirurgicznymi, w przebiegu których występuje prawdopodobieństwo bakteriemii[1].
Długoterminowy stan funkcjonalny osób, które przeżyły, jest dobry, a ich jakość życia zbliżona do grupy kontrolnej w tym samym wieku. Wydolność zastawki aortalnej wydaje się być najważniejszym czynnikiem wpływającym na wczesne i późne wyniki. Osoby z łagodną niewydolnością zastawki aortalnej są wolne od reoperacji z tego powodu przez okres do 25 lat[4].
Przypisy
edytuj- ↑ a b c d e f Mark H. Beers, Robert S. Porter, Thomas V. Jones, Justin L. Kaplan, Michael Berkwits(Redaktorzy): The Merck Manual-Podręcznik diagnostyki i terapii. Elsevier Urban&Partner, 2006, s. 3101-3102, język polski, ISBN 978-83-60290-99-6
- ↑ Dorra Abid, MD, Sahar Ben Kahla, MD, Souad Mallek at all.: Unrepaired persistent truncus arteriosus in a 38-year-old woman with an uneventful pregnancy. Cardiovasc J Afr. 2015 Jul-Aug; 26(4): e6–e8. ncbi.nlm.nih.gov. [dostęp 2022-04-26].
- ↑ Wen Ruan, Yee Jim Loh, Kenneth Wei Qiang Guo, and Ju Le Tan: Surgical correction of persistent truncus arteriosus on a 33-year-old male with unilateral pulmonary hypertension from migration of pulmonary artery band. J Cardiothorac Surg. 2016; 11: 39. ncbi.nlm.nih.gov. [dostęp 2022-04-26].
- ↑ a b Phillip S. Naimo and Igor E. Konstantinov: Surgery for Truncus Arteriosus: Contemporary Practice. Ann Thorac Surg 2021;111:1442-1450. www.annalsthoracicsurgery.org. [dostęp 2022-04-26].
- ↑ Wilson J, Baillie M. A description of a very unusual forma- tion of the human heart. Philos Trans R Soc Lond B Biol Sci. 1798;88:346-356
- ↑ Buchanan G. Malformation of the heart, undivided truncus arteriosus. Heart otherwise double. Trans Pathol Soc Lond. 1864;15:89-91
- ↑ Religa 1993 ↓, s. 197.
- ↑ [https://www.semtcvspeds.com/article/S1092-9126(02)70024-0/pdf Mark D. Rodefeld Frank L. Hanley: Neonatal truncus arteriosus repair: Surgical techniques and clinical management. SURGICAL TECHNIQUES AND CLINICAL MANAGEMENT, 2002, 5, 1, 212-217]. www.semtcvspeds.com. [dostęp 2022-04-26].
- ↑ a b Religa 1993 ↓, s. 200.
- ↑ a b Panagiotis G Sfyridis, Dimosthenis P Avramidis, George V Kirvassilis at all.: The contegra® valved heterograft conduit for right ventricular outflow tract reconstruction: a reliable solution. SURGICAL TECHNIQUES AND CLINICAL MANAGEMENT, 2002, 5, 1, 212-217. pubmed.ncbi.nlm.nih.gov. [dostęp 2022-04-26].
- ↑ Anthony A Holmes, Steve Co, Derek G Human,1 Jacques G LeBlanc, and Andrew IM Campbell: The Contegra conduit: Late outcomes in right ventricular outflow tract reconstruction. Ann Pediatr Cardiol. 2012 Jan-Jun; 5(1): 27–33. /www.ncbi.nlm.nih.gov. [dostęp 2023-10-17].
Bibliografia
edytuj- Andrzej Szczeklik (red.): Choroby wewnętrzne. Przyczyny, rozpoznanie i leczenie, tom I. Kraków: Wydawnictwo Medycyna Praktyczna, 2005. ISBN 83-7430-031-0.
- Hieronim Bartel: Embriologia podręcznik dla studentów. Warszawa: PZWL 2002.
- Zbigniew Religa, Zarys kardiochirurgii. W: Marian Zembala - Wspólny pień tętniczy, wyd. I, Warszawa: PZWL, 1993, ISBN 83-200-1732-7.