Zawłotnia śnieżna
Zawłotnia śnieżna (Chlamydomonas nivalis) – gatunek glonu z rodziny zawłotniowatych. Jednokomórkowa zielenica o postaci wiciowca. Kriobiont naśnieżny dający zakwity, znane jako czerwony śnieg, a w literaturze podróżniczej, zwłaszcza dotyczącej Stanów Zjednoczonych – śnieg arbuzowy[2].
| |
| Systematyka[1] | |
| Domena | |
|---|---|
| Królestwo | |
| Gromada | |
| Podgromada | |
| Klasa | |
| Rząd | |
| Rodzina | |
| Rodzaj | |
| Gatunek |
Zawłotnia śnieżna |
| Nazwa systematyczna | |
| Chlamydomonas nivalis F.A.Bauer (Wille) 1903 | |

Ze względu na trudności w oznaczaniu, czasem nazwę Chlamydomonas nivalis stosuje się jako zbiorczą dla wszystkich zawłotni tworzących czerwone zakwity śniegu[3].
Morfologia
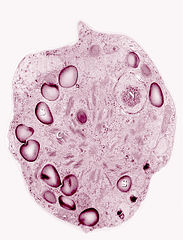
edytujKomórki najczęściej w postaci przetrwalnej, bezwiciowej. W przybliżeniu kuliste. Całkowicie czerwone, co maskuje chloroplast. Gruba ściana komórkowa, co daje wrażenie cysty. Pirenoid centralny. O rozmiarach od 6 μm do ponad 30 μm. Ze względu na wytwarzanie śluzu czasem oblepione materiałem obcym i sklejone z innymi komórkami, tworząc agregacje[3]. Oprócz chlorofilu a i b wytwarza barwniki takie jak: luteina, β-karoten i astaksantyna[4]. Ta ostatnia i jej estry to tzw. karotenoidy drugiego rzędu, występujące poza plastydami (hematochrom) wytwarzane m.in. w warunkach stresu, np. niedoboru azotu, ale przede wszystkim podczas formowania form przetrwalnych. W małych lub śladowych ilościach wytwarzany jest α-tokoferol czy echinenon. Również ksantofile inne niż luteina (tj. wiolaksantyna, anteraksantyna, zeaksantyna) są wytwarzane w mniejszych ilościach (mniej więcej ⅓ ilości luteiny) i to nie u wszystkich osobników. U osobników o w pełni wykształconym czerwonym zabarwieniu astaksantyny jest ok. dwudziestokrotnie więcej niż chlorofilu a[5].
Występowanie
edytujGatunek kosmopolityczny występujący na topniejącym śniegu. Jako element krioplanktonu żyje głównie w błonie tworzonej przez wodę na powierzchni śniegu, a w mniejszych zagęszczeniach w wodzie znajdującej się wewnątrz warstwy śniegu, między jego kryształami. Izolowane połacie śniegu kolonizuje przenoszony jako element aeroplanktonu[3]. Występuje w różnych miejscach, które osiągają granicę wiecznego śniegu, co w przypadku stref podbiegunowych oznacza poziom morza. W Afryce notowana w górach Maroka[5]. Na paku lodowym Oceanu Arktycznego zawłotnia śnieżna była notowana w zagęszczeniu średnio 156 000 komórek na mililitr topniejącego śniegu, osiągając niemal stuprocentową dominację wśród naśnieżnych glonów, natomiast w głębi śniegu i w zbiornikach roztopiskowych występuje w mniejszych zagęszczeniach[3]. Z kolei w górach Sierra Nevada średnie zagęszczenie wyniosło ok. 1 306 komórek w mililitrze[4]. Również w Alpach niemal wszystkie komórki tworzące czerwony śnieg należą do tego gatunku[5].
Biologia i ekologia
edytujEkofizjologia
edytujWytrzymuje zamarzanie do temperatury -35 °C[3]. Różne szczepy optimum fotosyntezy osiągają w różnych temperaturach od -3 °C do 20 °C, choć zwykle za optymalną temperaturę wzrostu podaje się 2–4 °C[6]. W razie stopienia śniegu może przetrwać kilka miesięcy w postaci wysuszonej, stając się elementem pyłu pokrywającego skały, po czym ponownie być aktywna po nowym opadzie śniegu[5]. Zakwity śniegu są tworzone przez nieruchliwe postacie przetrwalne (aplanospory), które do kiełkowania w postacie uwicione potrzebują wody w stanie płynnym[4], a więc w przypadku śniegu nie może on być zbyt suchy, czyli świeży. Postacie ruchliwe umiejscawiają się we właściwej lokalizacji względem światła i stref termicznych, ale większość cyklu życiowego zawłotnia spędza w postaci przetrwalnej, bardziej wytrzymałej na trudne warunki (np. cykl zamarzania i tajania)[5]. Formy przetrwalne nie pozostają całkowicie nieaktywne, lecz wykazują metabolizm[2]. W czasie badań zakwitu często wszystkie komórki są znajdowane właśnie w tej formie[3][5]. Przekształcenie w formę przetrwalną wymaga zgromadzenia substancji zapasowych (cukrów i lipidów) oraz pozachloroplastowych karotenoidów. Na początku sezonu wegetacyjnego proporcje barwników są inne niż w jego pełni – z czasem rośnie stosunek astaksantyny do chlorofilu, a maleje proporcja karotenoidów pierwszego rzędu i tokoferolu[5].
Astaksantyna prawdopodobnie pełni funkcję filtra chroniącego przed promieniowaniem ultrafioletowym, które może być szczególnie intensywne na śniegu[6].
Z otoczką śluzową oprócz zanieczyszczeń mineralnych (w warunkach paku lodowego w dużej mierze skorupek okrzemek[3]) związany może być kriofilny grzyb Chionaster nivalis[5].
Fotosynteza
edytujMimo właściwości kriofilnych, eksperymentalny wzrost temperatury nawet do 20 °C generalnie nie powoduje spadku wydajności fotosyntezy. Niemniej, przy małym naświetleniu (<100 mmol kwantów m-2 s-1) zysk netto z fotosyntezy obserwowano w zakresie 1,5–12 °C, a w wyższych temperaturach zysk netto był ujemny. W wyższych temperaturach (kilkanaście stopni Celsjusza) wzrost naświetlenia powoduje szybki wzrost tempa fotosyntezy, a punkt jej wysycenia następuje dopiero przy natężeniu ok. 900 mmol/m²/s, natomiast w warunkach bliższych typowym dla jej naturalnych siedlisk punkt ten to ok. 300 mmol kwantów m-2 s-1). Nie zaobserwowano fotoinhibicji. Nie jest jednak jasne, czy wnioski z krótkotrwałych warunków eksperymentalnych można przenieść na populacje występujące w naturze, w warunkach bardzo dużej zmienności warunków zależnych m.in. od głębokości położenia w warstwie śniegu[5].
Przypisy
edytuj- ↑ Chlamydomonas nivalis (F.A.Bauer) Wille. Algaebase. [dostęp 2013-01-04]. (ang.).
- ↑ a b William E. Williams, Holly L. Gorton, Thomas C. Vogelmann. Surface gas-exchange processes of snow algae. „Proceedings of the National Academy of Sciences of the United States of America”. 100 (2), s. 562-6, styczeń 2003. DOI: 10.1073/pnas.0235560100. PMID: 12518048.
- ↑ a b c d e f g Rolf Gradinger, Dirk Nürnberg. Snow algal communities on Arctic pack ice floes dominated by Chlamydomonas nivalis (Bauer) Wille. „Proc. NIPR Symp. Polar Biol.”. 9, s. 35–43, 1996. (ang.).
- ↑ a b c TH. Painter, B. Duval, WH. Thomas, M. Mendez i inni. Detection and quantification of snow algae with an airborne imaging spectrometer. „Applied and environmental microbiology”. 67 (11), s. 5267-72, listopad 2001. DOI: 10.1128/AEM.67.11.5267-5272.2001. ISSN 0099-2240. PMID: 11679355.
- ↑ a b c d e f g h i Daniel Remias, Ursula Lütz-Meindl, Cornelius Lütz. Photosynthesis, pigments and ultrastructure of the alpine snow alga Chlamydomonas nivalis. „European Journal of Phycology”. 3 (40), s. 259–268, 2005. DOI: 10.1080/09670260500202148. (ang.).
- ↑ a b Barbara Kawecka, Pertti Vesa Eloranta: Zarys ekologii glonów wód słodkich i środowisk lądowych. Warszawa: Wydawnictwo Naukowe PWN, 1994, s. 65, 80. ISBN 83-01-11320-0. (pol.).