Zespół delecji 22q11.2
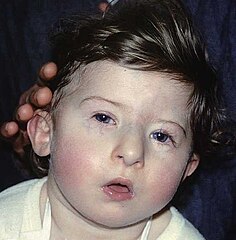
Zespół delecji 22q11.2 (inaczej zespół DiGeorge'a albo zespół mikrodelecji 22q11, ang. 22q11.2 deletion syndrome) – zespół wad wrodzonych spowodowany mikrodelecją prążka chromosomu 22q11 przebiegający z pierwotnym niedoborem odporności.
| |
| Klasyfikacje | |
| ICD-10 |
D82.1 |
|---|---|
| DiseasesDB | |
| OMIM | |
| MeSH | |


W zespole delecji 22q11.2 dochodzi do zaburzeń rozwoju grasicy i jej aplazji, najczęściej w 6.–10. tygodniu życia płodowego. Grasica rozwija się z III i IV kieszonki skrzelowej, więc zaburzenia jej rozwoju przebiegają wspólnie z zaburzeniami gruczołów przytarczycznych.
Historia
edytujHistorycznie opisano kilka zespołów wad wrodzonych, które z czasem okazały się stanowić spektrum jednego zespołu wad. Były to:
- wrodzona hipoplazja grasicy skojarzona z hipokalcemią
- zespół DiGeorge’a, opisany przez Angelo Di George’a w 1968[1].
- zespół Takao (conotruncal anomaly face syndrome)
- zespół podniebienno-sercowo-twarzowy (velocardiofacial syndrome, VCFS, zespół Shprintzena)
- zespół czaszkowo-twarzowy Caylera
- niektóre przypadki zespołu Opitza G/BBB
- zespół CATCH-22
Akronim CATCH-22 (ang. Paragraf 22) oznaczał:
- C = wady serca (cardiac defects)
- A = dysmorfia twarzy (abnormal facies)
- T = hipoplazja grasicy (thymic hypoplasia)
- C = rozszczep podniebienia (cleft palate)
- H = hipokalcemia wtórna do aplazji przytarczyc (hypocalcemia from parathyroid aplasia)
- 22 = mikrodelecje 22 chromosomu.
Obecnie zaleca się niestosowanie terminu CATCH22 z powodu pejoratywnego wydźwięku nazwy[2]: tytuł powieści Hellera Paragraf 22 jest też określeniem sytuacji bez wyjścia.
Epidemiologia
edytujZespół delecji 22q11.2 występuje w 1 na 4000 żywych urodzeń w Szwecji[3]. Zespół może być jednak częstszy ze względu na to, że niektórzy ludzie mają niewiele objawów i mogli zostać niezdiagnozowani.
Objawy
edytujObjawy są zmienne i obejmują:
- wrodzone wady serca (75%)
- tetralogia Fallota
- atrezja tętnicy płucnej z ubytkiem przegrody międzykomorowej
- truncus arteriosus
- przerwanie łuku aorty typu B (30%)
- ubytek przegrody międzyprzedsionkowej
- zaburzenia rozwoju podniebienia (69%)
- trudności w uczeniu (70-90%)
- pierwotny niedobór odporności (77%) spowodowany aplazją grasicy, co powoduje hipoplazję limfocytów T, laboratoryjnie charakteryzującą się znacznym wzrostem odsetka limfocytów B nad limfocytami T i areaktywnością w teście transformacji blastycznej. W związku z powyższym choroba przebiega z wzmożoną zapadalnością na choroby wirusowe, bakteryjne i grzybicze. Jej objawy pojawiają się w pierwszych 6 miesiącach życia
- hipokalcemię (średnio 30%) spowodowaną niedorozwojem gruczołów przytarczycznych. Rozpoznawana u 69–72% pacjentów z fenotypem zespołu DiGeorge’a, 13-22% pacjentów z fenotypem VCFS, 10% z CAFS, 49–60% z 22q11.2 del
- wrodzone wady nerek[4]
- trudności z karmieniem
- choroby autoimmunologiczne, takie jak reumatoidalne zapalenie stawów (150 razy większe ryzyko), niedokrwistość hemolityczna autoimmunologiczna, idiopatyczna plamica małopłytkowa, autoimmunologiczne enteropatie (choroba trzewna), bielactwo
- zwiększone ryzyko zachorowania na choroby psychiczne[5], w tym około 30-krotnie podwyższone ryzyko zachorowania na schizofrenię (wśród chorych na schizofrenię w 0,5% do 3% przypadków stwierdza się zespół mikrodelecji 22q11, podczas gdy w populacji ogólnej rozpowszechnienie zespołu mikrodelecji 22q11 wynosi 0,025%)[6][7].
Stowarzyszenie 22q11 Polska
edytujOd 2017 roku działa w Polsce Stowarzyszenie 22q11 Polska, założone przez rodziny dotknięte zespołem, które aktywnie działają na rzecz zwiększenia świadomości na temat choroby wśród lekarzy, terapeutów oraz samych rodziców. Co roku organizowany jest zjazd rodzin oraz konferencje i spotkania online z ekspertami. Stowarzyszenie prowadzi też grupę wsparcia na Facebooku, do której zaprasza wszystkie osoby, które otrzymały diagnozę zespołu mikrodelecji 22q11, zwanego przez wielu lekarzy zespołem Di George'a.
Przypisy
edytuj- ↑ DiGeorge AM. Congenital absence of the thymus and its immunologic consequences: concurrence with congenital hypoparathyroidism. White Plains, NY: March of Dimes-Birth Defects Foundation IV(1): 116-21. 1968
- ↑ Burn J: Closing time for CATCH22. J Med Genet 36:737–738, 1999
- ↑ Oskarsdóttir S, Vujic M, Fasth A. Incidence and prevalence of the 22q11 deletion syndrome: a population-based study in Western Sweden. „Arch Dis Child”. 89. 2, s. 148-51, 2004. PMID: 14736631.
- ↑ Lopez-Rivera E, Liu YP, Verbitsky M et al.. Genetic Drivers of Kidney Defects in the DiGeorge Syndrome. „N Engl J Med.”, 2017 Jan 25. DOI: 10.1056/NEJMoa1609009. PMID: 28121514. (ang.).
- ↑ M. Debbané, B. Glaser, MK. David, C. Feinstein i inni. Psychotic symptoms in children and adolescents with 22q11.2 deletion syndrome: Neuropsychological and behavioral implications.. „Schizophr Res”. 84 (2-3), s. 187-93, Jun 2006. DOI: 10.1016/j.schres.2006.01.019. PMID: 16545541.
- ↑ A. Horowitz, S. Shifman, N. Rivlin, A. Pisanté i inni. A survey of the 22q11 microdeletion in a large cohort of schizophrenia patients.. „Schizophr Res”. 73 (2-3), s. 263-7, Mar 2005. DOI: 10.1016/j.schres.2004.02.008. PMID: 15653270.
- ↑ AS. Bassett, EW. Chow, P. AbdelMalik, M. Gheorghiu i inni. The schizophrenia phenotype in 22q11 deletion syndrome.. „Am J Psychiatry”. 160 (9), s. 1580-6, Sep 2003. DOI: 10.1176/appi.ajp.160.9.1580. PMID: 12944331. PMCID: PMC3276594.
Linki zewnętrzne
edytuj- DIGEORGE SYNDROME; DGS w bazie Online Mendelian Inheritance in Man (ang.)
- DiGeorge's syndrome w bazie Who Named It (ang.)
- Donna M McDonald-McGinn, Beverly S Emanuel, Elaine H Zackai. 22q11.2 Deletion Syndrome GeneReviews
- Iftikhar Hussain. DiGeorge Syndrome eMedicine
- Grupa wsparcia dla rodziców dzieci z zespołem Di George’a (pol.)
- Stowarzyszenie 22q11 Polska
- Materiały informacyjne nt. zespołu dla lekarzy, terapeutów oraz rodziców.