Równanie Arrheniusa
Równanie Arrheniusa – równanie, podane przez szwedzkiego chemika Svantego Arrheniusa, wyrażające zależność stałej szybkości reakcji od temperatury[1][2][3]:
lub w postaci logarytmicznej:
gdzie:
- – stała szybkości reakcji,
- – czynnik przedeksponencjalny związany z częstością zderzeń skutecznych w danej reakcji,
- – podstawa logarytmu naturalnego,
- – energia aktywacji reakcji (J·mol−1),
- – temperatura (K),
- – uniwersalna stała gazowa wynosząca 8,31446261815324 J·mol−1·K−1.
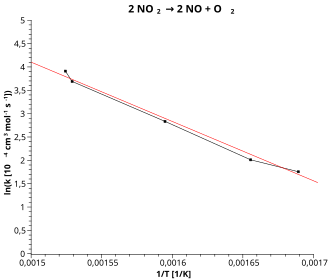
2 → 2 NO + O
2 zostały naniesione w układzie współrzędnych dając w przybliżeniu linię prostą
Równanie Arrheniusa w postaci logarytmicznej ma dwie zmienne, i i można je zapisać w postaci w której i są stałymi. Oznacza to, że między a zachodzi zależność liniowa. Dzięki temu, znając doświadczalne wartości stałych szybkości reakcji w kilku temperaturach, można łatwo wyznaczyć zarówno wartość stałej jak i energię aktywacji danej reakcji. Nachylenie uzyskanej linii ma wartość a punkt przecięcia linii z osią rzędnych ma wartość [1][2][3].
Równanie Arrheniusa dla procesów relaksacyjnych
edytujRównanie Arrheniusa opisywać może też procesy relaksacyjne drgań cząstek (np. atomów w cząsteczce) wzbudzonych termicznie. Ma ono wówczas postać[4]:
gdzie:
- – częstość relaksacji,
- – częstość drgań cieplnych,
- – energia aktywacji procesu relaksacyjnego.
Zobacz też
edytujPrzypisy
edytuj- ↑ a b Peter Atkins, Chemia fizyczna, PWN, 2012, s. 750–752, ISBN 978-83-01-13502-7.
- ↑ a b Zdzisław Ruziewicz, Krzysztof Pigoń, Chemia fizyczna. Tom 1. Podstawy fenomenologiczne, PWN, 2005, s. 523–525, ISBN 978-83-01-14484-5.
- ↑ a b Robert G. Mortimer, Physical Chemistry, wyd. 3, Elsevier/Academic Press, s. 533–534, ISBN 978-0-12-370617-1 (ang.).
- ↑ Andrzej Kajetan Wróblewski i inni red., Encyklopedia fizyki współczesnej, Warszawa: PWN, 1983, s. 659, ISBN 83-01-00391X.

















