Kwas nadjodowy
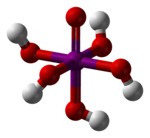
Kwas nadjodowy – nieorganiczny związek chemiczny, kwas tlenowy jodu na stopniu utlenienia VII. W zależności od zawartości wody w cząsteczce występuje w postaci orto (o wzorze H5IO6) i meta (o wzorze HIO4).
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||||||||||||||
| Wzór sumaryczny |
H5IO6 | ||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa |
227,94 g/mol | ||||||||||||||||||||||||||||||||||||||||||||||
| Wygląd |
kryształy[1] | ||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||||||||||||
| Inne aniony | |||||||||||||||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||||||||||||||||

| |||||||||||||||||||||
| |||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||
| Wzór sumaryczny |
HIO4 | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa |
191,91 g/mol | ||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||
| PubChem | |||||||||||||||||||||
| |||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||
| Inne aniony | |||||||||||||||||||||
Właściwości
edytujKwas nadjodowy jest białym ciałem stałym, rozpuszczalnym w wodzie (około 3 kg/l w 20 °C) oraz w alkoholu etylowym. Występuje w postaci rozpływających się w powietrzu kryształów. Jego temperatura topnienia zawiera się w granicach 124–127 °C. Powyżej tej temperatury następuje rozkład, podczas którego powstaje woda, tlen oraz tlenek jodu(V).
pH jego wodnych roztworów wynosi około 1,2 (100 g/l H2O w 20 °C). Ma właściwości higroskopijne.
Otrzymywanie
edytujKwas nadjodowy jest otrzymywany przez anodowe utlenienie kwasu jodowego.
Zastosowanie
edytujKwas ortojodowy jest używany w chemii organicznej do badania struktury związków organicznych. Może on oddzielać dwie grupy hydroksylowe z grup aldehydowych, znajdujących się przy sąsiadujących atomach węgla. Jest to pomocne przy określaniu struktur węglowodanów[4].
Toksyczność
edytujSubstancja, podobnie jak w przypadku innych związków jodu, powoduje uczulenie. Może powodować astmę, zapalenie oskrzeli czy też wysypkę.
Przy spożyciu występują oparzenia przełyku i żołądka. Działa parząco na oczy.
Pierwsza pomoc
edytujPrzy kontakcie substancji z oczami lub skórą należy przemyć je dużą ilością wody (w wypadku oczu – przy szeroko odchylonej powiece).
Po spożyciu należy podać choremu dużą ilość wody. Nie powinno się wywoływać wymiotów (aby nie doprowadzić do perforacji przewodu pokarmowego) oraz zobojętniać substancji.
Ponadto należy skontaktować się z lekarzem.
Przypisy
edytuj- ↑ a b c d Farmakopea Polska X, Polskie Towarzystwo Farmaceutyczne, Warszawa: Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, 2014, s. 4276, ISBN 978-83-63724-47-4.
- ↑ a b Kwas nadjodowy. [martwy link] The Chemical Database. Wydział Chemii Uniwersytetu w Akronie. [dostęp 2013-04-07]. (ang.).[niewiarygodne źródło?]
- ↑ a b Kwas nadjodowy (nr 379891) – karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Polski.
- ↑ R.T. Morrison, R.N. Boyd: Chemia organiczna. PWN, 1990.
Bibliografia
edytuj- Karta charakterystyki kwasu nadjodowego.
- Kwasy tlenowe jodu. [zarchiwizowane z tego adresu (2008-05-23)].
- Witold Mizerski: Tablice chemiczne. Warszawa: wyd. Adamantan, 2004.

