Candida albicans
Candida albicans (C.P. Robin) Berkhout – gatunek grzybów zaliczany do klasy Saccharomycetes[1]. Ma polską nazwę bielnik biały, ale w praktyce używana jest niemal wyłącznie nazwa naukowa. Jest to grzyb bezotoczkowy, wywołujący zakażenia oportunistyczne u chorych z obniżoną odpornością. Stanowi on florę fizjologiczną przewodu pokarmowego u 40–80% populacji.
| |
| Systematyka | |
| Domena | |
|---|---|
| Królestwo | |
| Typ | |
| Klasa | |
| Rząd | |
| Rodzina | |
| Rodzaj | |
| Gatunek |
Candida albicans |
| Nazwa systematyczna | |
| Candida albicans (C.P. Robin) Berkhout De Schimmelgesl. Monilia, Oidium, Oospora en Torula, Disset. Ultrecht: 44 (1923) | |


Systematyka i nazewnictwo
edytujPozycja w klasyfikacji według Index Fungorum: Candida, Incertae sedis, Saccharomycetales, Saccharomycetidae, Saccharomycetes, Saccharomycotina, Ascomycota, Fungi[1].
Po raz pierwszy, w 1853 roku, takson ten zdiagnozował Charles Philippe Robin, nadając mu nazwę Oidium albicans. Obecną, uznaną przez Index Fungorum, nazwę nadała mu w 1923 roku Christine Marie Berkhout, przenosząc go do rodzaju Candida[1].
Gatunek ten ma ponad 200 synonimów. Niektóre z nich:
- Candida stellatoidea (C.P. Jones & D.S. Martin) Langeron & Guerra
- Oidium albicans C.P. Robin[2].
Morfologia i genetyka
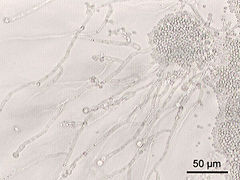
edytujCandida albicans jest grzybem dymorficznym, mogącym istnieć w postaci strzępkowej i drożdżowej. Dokładniej, jest grzybem termodymorficznym, tzn. że zależy to od temperatury. Ogromna większość gatunków tych grzybów w wyższej temperaturze (w temperaturze ciała ssaków) tworzy chorobotwórczą formę drożdżową, ale C. albicans jest wyjątkiem – w takiej temperaturze tworzy formę strzępkową[3].
Obecność 34 antygenów (zbudowanego głównie z mannanu) pozwala na różnicowanie w obrębie gatunku. Ze względu na różnicę jednego antygenu wyodrębniono C. albicans typ A (który posiada składnik antygenowy o numerze 6) od typu B, który tego składnika nie posiada[4].
Według analizy rRNA małej podjednostki rybosomu (16S), C. albicans razem z innymi przedstawicielami rodzaju Candida (C. tropicalis, C. parapsilosis i C. viswanathii) tworzy silnie wyodrębnioną od innych patogennych grzybów grupę[5].
C. albicans jest gatunkiem diploidalnym, posiada 8 par chromosomów. Genom C. albicans został w całości zsekwencjonowany w 2004 roku, liczy nieco ponad 14 milionów par zasad (wielkość haploidalnego genomu)[6].
Charakterystyczną cechą tego gatunku są często występujące rearanżacje chromosomowe (translokacje, delecje fragmentów chromosomów oraz aneuploidie) mogące prowadzić do zmian fenotypowych, co jest częścią strategii adaptacyjnej[7]. Zmiany w kariotypie występują często wśród izolatów klinicznych[8].
C. albicans korzysta z niestandardowego kodu genetycznego. Triplet CUG oznacza serynę, a nie leucynę, jak w standardowym kodzie genetycznym[9]. Podobna sytuacja ma miejsce w przypadku innych grzybów z rodzaju Candida (np. C. parapsilosis, C. dubliniensis, C. tropicalis, ale nie u C. glabrata. Rodzaj Candida nie jest monofiletyczną jednostką systematyczną. Gatunek C. glabrata (znany również pod nazwą Torulopsis glabrata) jest bliżej spokrewniony z drożdżami piekarniczymi (Saccharomyces cerevisiae) niż z C. albicans[10]), a także m.in. u Debaryomyces hansenii, Pichia stipitis i Pichia farinosa. Gatunki te należą do jednostki systematycznej określanej mianem kladu CTG[11].
Chorobotwórczość
edytujPodobnie jak w przypadku pozostałych grzybic, także tutaj infekcji sprzyja przewlekła antybiotykoterapia, osłabienie odporności, sztuczne zastawki, cewniki, zabiegi inwazyjne etc. Zazwyczaj kandydozę dzieli się na powierzchowną oraz znacznie poważniejszą uogólnioną. Obecność grzybów w moczu określa się mianem kandydurii.
Diagnostyka
edytuj- Preparat bezpośredni
W przypadku kandydozy powierzchownej biomateriał zanurzany jest w roztworze wodorotlenku potasu, który niszczy keratynę, nie wpływając na komórki grzyba. W preparacie mikroskopowym C. albicans widoczne są blastospory (pączkujące komórki), pseudostrzępki, czasami strzępki prawdziwe.
- Hodowla
Grzyb wzrasta na pożywce Sabourauda w ciągu 2–4 dni, tworząc białe do kremowych kolonie o masłowatej konsystencji. Brzeg kolonii jest gładki, czasami frędzlowaty ze względu na wytwarzaną grzybnię.
Wstępna identyfikacja opiera się na stwierdzeniu w hodowli na podłożu zubożonym (podłoże ryżowe) pod szkiełkiem nakrywkowym charakterystycznych zarodników przetrwalnikowych – chlamydospor. Drugą metodą jest wykonanie testu filamentacji (ang. germ tube test), który polega na inkubacji komórek C. albicans w surowicy przez 2–3 godziny w temperaturze 37 °C. Po tym czasie komórki „kiełkują” tworząc strzępki rostkowe, które w przeciwieństwie do tworzonych pączków lub pseudostrzępek nie są oddzielone ścianą komórkową. Powyższe testy nie pozwalają na różnicowanie C. albicans od C. dubliniensis dlatego potrzebne są dalsze testy najczęściej auksanograficzne.
- Testy serologiczne
Testy serologiczne wykorzystywane są do wstępnej diagnostyki zakażeń narządowych i uogólnionych oraz do monitorowania skuteczności leczenia. Nie pozwalają jednak na jednoznaczne określenie gatunku.
Diagnostyka oparta o metodę qPCR (reakcja łańcuchowa polimerazy w czasie rzeczywistym)
Metoda pozwala zidentyfikować poszczególne gatunki grzybów z rodzaju Candida (albicans, tropicalis, glabrata, krusei, para-ortho- metapsilosis) oraz określić ich liczebność, a w przypadku zakażeń mieszanych podaje odsetkowy udział poszczególnych gatunków grzybów w pobranej od pacjenta próbce.
- Profil biochemiczny
Grzyb asymiluje glukozę, maltozę, sacharozę i galaktozę, ale nie laktozę. Dwa pierwsze węglowodany drobnoustrój fermentuje z wytworzeniem gazu, czwarty (galaktozę) tylko do kwasu. Fermentacja galaktozy jest zależna od szczepu. Grzyb nie wytwarza ureazy[4].
Tworzenie biofilmu
edytujC. albicans jest uważany za największego producenta biofilmu wśród gatunków Candida. Dojrzałe biofilmy C. albicans wykazują heterogeniczną strukturę, złożoną z blastoforów i strzępek otoczonych ECM złożoną z materiału polisacharydowego. ECM zapewnia rusztowanie strukturalne dla przyczepności między komórkami i różnymi powierzchniami oraz barierę między komórkami w warstwie a otaczającym środowiskiem[12].
Wczesna faza powstawania biofilmu rozpoczyna się od przylegania komórek drożdży do danej powierzchni, a następnie tworzenia odrębnej kolonii. Następnie, w fazie pośredniej, komórki organizują się i zaczynają wytwarzać pozakomórkowe substancje polimerowe (EPS). Składniki te umożliwiają dojrzewanie trójwymiarowej struktury. Po utworzeniu dojrzałego biofilmu komórki biofilmu rozprzestrzeniają się, odłączając i migrując do innych miejsc. Proces dojrzewania trwa zwykle około 38–72 godzin in vitro, zaś in vivo około 24 godzin[12].
U C. albicans proces tworzenia biofilmu ściśle związany jest z produkcją adhezyn. Zasadniczo adhezyny są białkami ściany komórkowej glikozylofosfatydyloinozytolu (GPI-CWPs), obejmującymi kotwicę GPI, domenę serynowo/treoninową i domenę wiążącą węglowodany lub peptydy. U C. albicans, kilka adhezyn należy do rodziny Als (sekwencja podobna do aglutyniny). Spośród 8 członków rodziny Als, Als3 odgrywa najważniejszą rolę w tworzeniu biofilmu, ponieważ jego usunięcie prowadzi do poważnych defektów w porównaniu ze szczepem rodzicielskim. Inną ważną rodziną adhezyn w C. albicans jest rodzina białka ściany strzępki (Hwp), w tym Hwp1. Hwp1 jest mannoproteiną ściany komórkowej zarodników i komórek strzępkowych, odgrywającą ważną rolę w tworzeniu biofilmu. Oprócz Hwp1 do rozwoju biofilmu potrzebne są również cztery inne białka z rodziny Hwp: Hwp2, Rbt1, Eap1 i Ywp1.[12]
Biofilmy C. albicans są bardziej zlewne niż inne biofilmy z gatunku Candida, wykazując różne formy morfologiczne: owalne pąki, ciągłe strzępki i pseudostrzępki w zainfekowanych tkankach. Biofilmy C. albicans są większe na powierzchniach zbudowanych z lateksu i elastomeru silikonowego, a mniejsze na poliuretanie i na silikonie, w porównaniu do polichlorku winylu[12]. Ma to istotne znaczenie w produkcji sprzętu medycznego. Odkryto, że polieterouretan z 6% tlenkiem polietylenu znacznie zmniejsza całkowitą biomasę biofilmu, a także aktywność metaboliczną komórek w biofilmie.
Biofilmy Candida albicans wykazują synergię z czterema gatunkami bakterii: Streptococcus mutans, Streptococcus sanguinis, Actinomyces viscosus i Actinomyces odontolyticus. Zwiększonemu rozwojowi strzępek towarzyszy nadekspresja genów HWP1, ALS3 i EPA1. Staphylococcus aureus z C. albicans tworzą dwuwarstwową strukturę. Wizualizacja tych podwójnych warstw pokazała pierwszą warstwę biofilmu C. albicans przyczepioną do powierzchni pokrytej jedną warstwą S. aureus, która jest zawarta w macierzy pozakomórkowej utworzonej przez komórki Candida. Udowodniono, że ten ECM chroni S. aureus przed zabiciem przez wankomycynę. Podobnie jest w zależności C. albicans ze Staphylococcus epidermidis. Występuje antagonizm między Pseudomonas aeruginosa a C.albicans. Komórki P. aeruginosa przyczepiają się do włókien C. albicans, tworząc biofilm nad strzępkami zamiast na powierzchni. Tworzenie biofilmu ostatecznie prowadzi do śmierci komórek nitkowatych C. albicans, choć komórki drożdży pozostają żywotne[12].
Leczenie
edytujW przypadku zakażenia stosowane są następujące leki przeciwgrzybicze:
- imidazole – jako leki pierwszego rzutu, np. klotrimazol, mikonazol, ketokonazol
- polieny[13].
- Najskuteczniejsze, ale równocześnie najbardziej toksyczne środki – amfoterycyna B oraz jej mniej nefrotoksyczne preparaty (AmBisome, Amphocil i Abelcet) – używane są wyłącznie do leczenia groźnych fungemii[13].
- nystatyna używana jest do leczenia kandydoz powierzchownych[13].
- Ze względu na obecność peptydoglikanu w ścianie komórkowej aktywność zachowują także echinokandyny (mikafungina, kaspofungina, anidulafungina).[potrzebny przypis]
Przypisy
edytuj- ↑ a b c Index Fungorum [online] [dostęp 2013-11-12].
- ↑ Species Fungorum [online] [dostęp 2016-03-28] (ang.).
- ↑ Britanny A. Gianetti Sauzanne M. Noble, Jessica N. (February 2017).” Jessica N. Witchley, Candida albicans cell-type switching and functional plasticity in the mammalian host”, „Nature Reviews Microbiology”, 15 (2), 2017, s. 96–108, DOI: 10.1038/nrmicro.2016.157, ISSN 1740-1534, PMID: 27867199, PMCID: PMC5957277.
- ↑ a b Maria Lucyna Zaremba, Jerzy Borowski, Mikrobiologia lekarska, wyd. III, Wydawnictwo Lekarskie PZWL, ISBN 83-200-2896-5.
- ↑ S.M. Barns i inni, Evolutionary relationships among pathogenic Candida species and relatives, „Journal of Bacteriology”, 173 (7), 1991, s. 2250–2255, PMID: 2007550.
- ↑ Ted Jones i inni, The diploid genome sequence of Candida albicans, „Proceedings of the National Academy of Sciences of the United States of America”, 19, 2004, s. 7329–7334, DOI: 10.1073/pnas.0401648101, ISSN 0027-8424, PMID: 15123810, PMCID: PMC409918 [dostęp 2016-01-09].
- ↑ Anna Selmecki, Anja Forche, Judith Berman, Genomic Plasticity of the Human Fungal Pathogen Candida albicans, „Eukaryotic Cell”, 7, 2010, s. 991–1008, DOI: 10.1128/EC.00060-10, ISSN 1535-9778, PMID: 20495058, PMCID: PMC2901674 [dostęp 2016-01-09].
- ↑ Feng Yang i inni, High-Frequency Genetic Contents Variations in Clinical Candida albicans Isolates, „Biological and Pharmaceutical Bulletin”, 5, 2011, s. 624–631, DOI: 10.1248/bpb.34.624 [dostęp 2016-01-09].
- ↑ M A Santos, M F Tuite, The CUG codon is decoded in vivo as serine and not leucine in Candida albicans., „Nucleic Acids Research”, 9, 1995, s. 1481–1486, ISSN 0305-1048, PMID: 7784200, PMCID: PMC306886 [dostęp 2016-01-09].
- ↑ Sascha Brunke, Bernhard Hube, Two unlike cousins: Candida albicans and C. glabrata infection strategies, „Cellular Microbiology”, 5, 2013, s. 701–708, DOI: 10.1111/cmi.12091, ISSN 1462-5822, PMID: 23253282, PMCID: PMC3654559 [dostęp 2016-01-09].
- ↑ David A Fitzpatrick i inni, BMC Evolutionary Biology, „BMC Evolutionary Biology”, 1, 2006, DOI: 10.1186/1471-2148-6-99, PMID: 17121679, PMCID: PMC1679813 [dostęp 2016-01-09].
- ↑ a b c d e Mafalda Cavalheiro, Miguel Cacho Teixeira, Candida Biofilms: Threats, Challenges, and Promising Strategies, „Frontiers in Medicine”, 5, 2018, s. 28, DOI: 10.3389/fmed.2018.00028, ISSN 2296-858X, PMID: 29487851, PMCID: PMC5816785 [dostęp 2020-01-27].
- ↑ a b c Danuta Dzierżanowska, Antybiotykoterapia praktyczna, wyd. 4, s. 189–225, ISBN 978-83-7522-013-1.
Bibliografia
edytuj- Gabriel Virella: Mikrobiologia i choroby zakaźne. Wrocław: "Urban & Partner", 2000, s. 387–388. ISBN 83-85842-59-4.
- Janus Andrzej, Nie daj się zjeść grzybom Candida, ISBN 978-83-921922-5-1.