Wirusy
Wirusy (łac. virus „trucizna, jad”) – niewielkie cząstki zakaźne infekujące wszystkie formy życia, niezdolne do namnażania się poza komórką pełniącą rolę gospodarza.

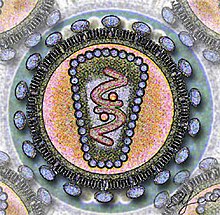

A. Wirusy bezotoczkowe B. Wirusy otoczkowe
1. Kapsyd
2. Kwas nukleinowy
3. Kapsomer
4. Nukleokapsyd
5. Wirion
6. Osłonka lipidowa
7. Wypustki
Wirusy nie mają struktury komórkowej, własnych układów metabolicznych, ani nie zawierają organelli[a]. W związku z tym nie zalicza się ich do organizmów. Z drugiej strony do żywych istot upodabnia je zdolność do reprodukcji, posiadanie genów i podleganie ewolucji. Najprostsze wirusy są zbudowane z kwasu nukleinowego stanowiącego ich genom oraz otaczającego go płaszcza białkowego zwanego kapsydem. Zawierają jeden z dwóch kwasów nukleinowych – RNA (wirusy RNA) albo DNA (wirusy DNA), w którym zawarta jest informacja potrzebna do wytworzenia cząstek potomnych.
Wirusy są wewnątrzkomórkowymi pasożytami bezwzględnymi – są całkowicie zależne od żywych komórek pełniących rolę ich gospodarza. Niektóre wirusy mają własne enzymy, ale nie pozwalają im one na samodzielne powielanie się czy wykorzystanie informacji z własnego genomu. Do namnażania wykorzystują maszynerię komórki będącej żywicielem. Są obecne w praktycznie każdym ekosystemie, także w środowiskach o ekstremalnych warunkach dla rozwoju życia. Są wielokrotnie liczniejsze niż bakterie i wszystkie inne organizmy razem wzięte.
Dziedziną nauki zajmującą się wirusami jest wirusologia.
Charakterystyka wirusów edytuj
Budowa wirusów edytuj
Dojrzała, kompletna cząstka wirusowa nazywana jest wirionem[2][b]. Wirion składa się z dwóch podstawowych elementów: kwasu nukleinowego, stanowiącego wirusowy genom, oraz otaczającego go płaszcza białkowego – kapsydu[1][6]. Kompleks wirusowego genomu i chroniących go białek (białek strukturalnych)[7] nazywa się nukleokapsydem[8]. Wirus może kodować także inne białka (niestrukturalne), które nie są obecne w wirionie (tj. cząstce wirusa znajdującej się w środowisku pozakomórkowym), ale pełnią różne ważne funkcje w cyklu replikacyjnym wirusa[7].
Kwas nukleinowy (genom) stanowiący dziedziczną informację genetyczną wirusa, może być cząsteczką RNA albo DNA[9]. Może mieć postać jedno- lub dwuniciową, liniową lub kolistą, ciągłą lub segmentowaną[10]. Kapsyd zbudowany jest z podjednostek białkowych zwanych kapsomerami, których liczba jest ściśle określona dla danego gatunku wirusa. Kapsomery są strukturami kulistymi lub cylindrycznymi[6], które z kolei zbudowane są z protomerów[11].
Niektóre wirusy mają dodatkowo osłonkę lipidową (nazywaną także otoczką) otaczającą nukleokapsyd[12][13], która pochodzi zwykle z błony cytoplazmatycznej gospodarza; czasem z jego błony jądrowej lub błony siateczki śródplazmatycznej[14]. Nabywają ją typowo w wyniku wypączkowania, dzięki czemu mogą opuścić komórkę bez rozrywania i zabijania jej. Białka w tej błonie pochodzące od komórki gospodarza są częściowo lub całkowicie zastępowane białkami wirusowymi, glikoproteinami[13], które często przyjmują postać wypustek (peplomerów)[14]. Osłonki występują głównie u wirusów atakujących komórki zwierzęce, rzadsze są u wirusów roślin i bardzo rzadkie u fagów[15].
Podjednostki białkowe w kapsydach są ułożone w ściśle określony sposób[16]. Ze względu na kształt i ułożenie kapsomerów wirusy można podzielić na[11]:
- wirusy o symetrii helikalnej;
- wirusy o symetrii ikozaedralnej (kubicznej);
- wirusy o symetrii złożonej[10].
Wirusy o budowie helikalnej mają kształt pałeczkowaty, wydłużony[16]. Niektóre z nich są sztywne i stosunkowo krótkie (np. wirus mozaiki tytoniu); inne są zaś długie i elastyczne (fagi nitkowate takie jak np. bakteriofag M13)[17].
Wirusy o symetrii ikozaedralnej mają strukturę o dwudziestu trójkątnych ścianach i dwunastu wierzchołkach. Wszystkie zwierzęce wirusy zawierające DNA (poza pokswirusami) mają kapsydy o takim kształcie[9]. W gorszej jakości obrazie z mikroskopu elektronowego kształt tych wirusów może jawić się jako kulisty[18].
Choć większość wirusów można przypisać do jednej z dwóch powyższych kategorii, niektóre wirusy nie pasują ani do jednej, ani do drugiej. Określa się je wirusami o symetrii złożonej, do których należą m.in. pokswirusy i pewne bakteriofagi[19]. Wirusy osłonkowe uznaje się czasem za osobną kategorię przy podziale wirusów ze względu na budowę[11]. Wiele takich wirusów ma po wewnętrznej stronie osłonki białko macierzy (białko M) mogące stanowić połączenie między nią a nukleokapsydem[20]. Wypustki tych wirusów wystają ponad osłonkę, a także mogą przebijać się wewnątrz cząstki wirusa przez dwuwarstwę lipidową i mieć kontakt z leżącą niżej warstwą białkową tworzoną przez białka M. U niektórych wirusów warstwa ta jest sztywna, u innych łatwo ulega odkształceniom[9].
Rozmiar wirusów podaje się zazwyczaj w nanometrach (1 nm = 10−9 m). Ważne z medycznego punktu widzenia wirusy mają typowo rozmiar od 18 nm (zaliczane do małych – parwowirusy) do 300 nm (zaliczane do dużych – pokswirusy)[21]. Wirusy są z reguły mniejsze niż bakterie i zdecydowana większość przedostaje się przez filtry mikrobiologiczne zatrzymujące bakterie[22]. Niektóre jednak są zatrzymywane, dlatego samo kryterium rozmiaru nie jest wystarczające, by dokonać rozróżnienia. Jeden z największych znanych wirusów, mimivirus, ma średnicę 400 nm, a najmniejsze bakterie (Mycoplasma, Ralstonia pickettii) mają zaledwie 200–300 nm długości[22]. Do innych gigantycznych wirusów należą pandorawirusy osiągające rozmiar 1 × 0,5 mikrometrów, które są większe nie tylko od wielu bakterii, ale także od niektórych pasożytniczych komórek eukariotycznych. Jeszcze większy od nich jest odkryty w wiecznej zmarzlinie Pithovirus sibericum, osiągający 1,5 μm długości[23][24].
Występowanie edytuj
Wirusy infekują wszystkie komórkowe formy życia[1][25]. Są obecne w organizmach zarówno chorych, wykazujących objawy chorobowe, jak i zdrowych, które są zakażone bez wywoływania następstw chorobowych, z infekcją aktywną lub utajoną. Poza gospodarzami wirusy występują w środowisku – glebie, powietrzu, wodzie[25].
Co więcej, wiele organizmów żywych zawiera w swoich genomach pozostałości dawnych genomów wirusowych, które w dalekiej przeszłości uległy integracji z genomem gospodarzy[25]. Także w genomie człowieka występują liczne zintegrowane z nim sekwencje wirusowe, tzw. EVE (ang. Endogenous Viral Elements). Około 8% ludzkiego genomu stanowią retrowirusowe sekwencje HERV (ang. Human Endogenous RetroVirus)[26].
Skład wiromu człowieka nie jest dobrze poznany, niewiele wiadomo, jaki ma wpływ na fizjologię i zdrowie. Badania wskazują na duże zróżnicowanie wiromu człowieka w zależności m.in. od diety, klimatu, zakażeń, statusu immunologicznego, wieku. Szacuje się, że 109–1015 cząstek wirusów przypada na gram jelit, a 106 przypada na 1 cm² skóry. Ponadto osoby całkowicie zdrowe mogą być zakażone przewlekle bądź przejściowo kilkoma różnymi wirusami[26].
Wirusy są zdecydowanie najbardziej licznym biologicznym bytem na Ziemi. Szacuje się, że liczba wszystkich bakterii wynosi około 5 × 1030, a liczba wirusów jest co najmniej 10 razy większa. W efekcie jest ich więcej niż wszystkich innych form życia razem wziętych[27]. Można je spotkać we wszystkich niszach, gdzie występują organizmy żywe, łącznie z najmniej przyjaznymi dla rozwoju życia[27].
W wirusologii ma się do czynienia z bardzo małymi cząstkami, jednak zwykle w dużych ilościach. Stężona zawiesina wirusów może zawierać 1012 wirionów w mililitrze. Pojedyncza zainfekowana komórka może wyprodukować 105 wirionów, a osoba zakażona HIV może wyprodukować 1011 cząstek wirusowych dziennie[28].
Niezależnie od przyjętej teorii pochodzenia wirusów faktem jest, że wirusy od miliardów lat wpływają na ewolucję organizmów jedno- i wielokomórkowych[29]. Dotychczas odkryto niewielki ułamek wirusów występujących na Ziemi. Najwięcej poznano wirusów infekujących ludzi, ponieważ w nauce najwięcej uwagi poświęca się właśnie tej grupie wirusów i zdrowiu człowieka[25].
Materiał genetyczny wirusów edytuj
Wszystkie organizmy żywe mają genom w postaci dwuniciowego DNA[30]. W przypadku wirusów jest więcej możliwości. Genom wirusa stanowi jedna lub wiele cząsteczek[31] jednego z dwóch kwasów nukleinowych – RNA (wirusy RNA) albo DNA (wirusy DNA), w którym zawarta jest informacja potrzebna do wytworzenia cząstek potomnych[1]. Mogą być one jednoniciowe albo dwuniciowe. Te zawierające dwuniciowy DNA (dsDNA) pod względem mechanizmów replikacji i transkrypcji są najbardziej zbliżone do organizmów żywych[30].
Jednoniciowy RNA jako genom wirusów może mieć polarność dodatnią (+) lub ujemną (-)[32]. W przypadku RNA o polarności dodatniej może być on użyty bezpośrednio w roli mRNA, a sam taki wyizolowany genom może być zakaźny. Natomiast u wirusów RNA o polarności ujemnej musi najpierw ulec transkrypcji[33], jest komplementarny (antysensowny) do mRNA[32]. Genomowy RNA wirusa może być też dwuniciowy (zawierać jedną nić o polarności dodatniej i drugą o polarności ujemnej) lub ambisensowny (jedna nić[32] zawiera sekwencje zarówno o polarności dodatniej, tj. stanowiące bezpośrednio matrycę do syntezy białka, jak i ujemnej, tj. stanowiące matrycę do syntezy mRNA[34]).
Większość wirusów zawiera pojedynczą kopię swojego genomu[32]. Do wyjątków należą retrowirusy, które zawierają dwie kompletne kopie swojego genomu stanowiącego pojedynczą nić RNA. Można je określić jako pseudodiploidalne[35].
W przypadku wirusów DNA właściwie wszystkie ważne z punktu widzenia zdrowia człowieka grupy tych wirusów mają pojedynczą cząsteczkę DNA w formie liniowej lub kolistej. W przypadku wirusów RNA są to pojedyncze cząsteczki liniowe lub ich genom składa się z kilku segmentów (części) RNA[33].
Genomy wirusowe są na ogół o wiele mniejsze niż genomy organizmów komórkowych[36]. Ich rozmiar jest jednak zróżnicowany. Na przykład cirkowirus świń (ssDNA) ma mały genom o wielkości 1,7 kilozasad (kz). Największe genomy mają wirusy zawierające dsDNA, a ich rozmiar może przekraczać 1000 kilo par zasad (kpz). Niektóre genomy wirusowe, jak te u mimiwirusów, są nawet większe niż najmniejsze genomy organizmów komórkowych (jak mykoplazmy). Największe genomy wirusów RNA osiągają rozmiary zaledwie 33 kz[31]. Jeśli chodzi o liczbę genów, przykładowo genomy wirusów roślin zawierają geny (otwarte ramki odczytu) w liczbie od 1 (satelitarny wirus nekrozy tytoniu) do 12 (reowirusy)[37].
Wirusy mają stosunkowo małe genomy z kilku powodów. Po pierwsze: mogą korzystać z białek komórki gospodarza, w związku z czym nie muszą same ich kodować (są jednak i takie białka, które muszą kodować same, jak polimeraza RNA zależna od RNA u wirusów RNA). Po drugie: informacja w genomie jest zakodowana w sposób efektywny i oszczędny; geny mogą nakładać się na siebie. Po trzecie: białka wirusowe mogą być wielofunkcyjne, wykazywać kilka różnych aktywności enzymatycznych[36].
Poza informacją o budowie białek wirusowych genom zawiera także dodatkowe informacje, jak sygnały kontrolujące ekspresję genów. Mogą być one zawarte w sekwencji nukleotydów, a w przypadku genomów jednoniciowych – w strukturach powstałych w wyniku sparowania zasad między komplementarnymi sekwencjami takich pojedynczych nici[38]. Należą do nich struktury spinki do włosów (ang. stem-loop), wybrzuszenia (wypętlenia, ang. bulges)[38][39], pseudowęzły. Tworzą one struktury wyższego rzędu[38].
W wyniku replikacji DNA niektórych wirusów, jak herpeswirusy czy bakteriofag T-4, powstają ogromne cząsteczki DNA, zwane konkatamerami. Każda z nich składa się wielu kopii wirusowego genomu. Kiedy składane są wiriony, odpowiednia endonukleaza odcina poszczególne sekwencje genomowe z konkatameru[40].
Klasyfikacja edytuj
Klasyfikacja wirusów bywa problematyczna. Opiera się ona na morfologii, typie kwasu nukleinowego, sposobie replikacji, organizmie gospodarza i rodzaju choroby, którą dany wirus wywołuje[41]. Do tego dochodzi porównywanie sekwencji nukleotydowych w genomach z użyciem narzędzi bioinformatycznych[42]. Od 1966 klasyfikacją i nazewnictwem wirusów zajmuje się Międzynarodowy Komitet Taksonomii Wirusów (ICTV)[43].
Podstawowymi kryteriami w klasyfikacji wirusów są:
- rodzaj kwasu nukleinowego (DNA lub RNA);
- liczba nici kwasu nukleinowego i ich postać;
- polarność genomu wirusa[c];
- symetria nukleokapsydu;
- występowanie osłonki lipidowej[45].
Przez długi czas wirusolodzy w klasyfikacji wirusów niechętnie używali takich samych jednostek taksonomicznych, jak w przypadku organizmów żywych. Później zorganizowano je w gatunki, rodzaje, podrodziny i rodziny. Niektóre rodziny przyporządkowano do rzędów, ale wyższe jednostki jak klasa czy typ nie były stosowane[42]. W 2005 wyróżniano 3 rzędy, 73 rodziny i 287 rodzajów[5]. Natomiast w klasyfikacji z 2019 wydanej przez ICTV najwyższą rangą taksonomiczną dla wirusów jest kategoria określana jako realm, których jest 4; następnie wyróżniono 9 królestw, 16 typów, 2 podtypy, 36 klas, 55 rzędów, 8 podrzędów, 168 rodzin, 103 podrodzin i 1421 rodzajów[46].
Co do nazewnictwa ustalono następujące przyrostki dla poszczególnych rang: realm –viria, subrealm –vira, królestwo –virae, podkrólestwo –virites, typ –viricota, podtyp –viricotina, klasa –viricetes, podklasa –viricetidae, rząd –virales, podrząd –virineae, rodzina –viridae, podrodzina –virinae, rodzaj –virus oraz podrodzaj –virus. Osobne przyrostki ustalono dla wiroidów i satelitarnych kwasów nukleinowych[47].
W obrębie gatunku wirusa wyróżnia się różne jego warianty, które określa się w kategoriach szczepu, serotypu (opierając się na różnicach w antygenach) czy genotypu (bazując na różnicach w sekwencji genomowej)[42].
Dodatkowy system klasyfikacji opracował David Baltimore – jest to tak zwana klasyfikacja Baltimore’a. Wirusy są w nim przydzielone do jednej z siedmiu grup zgodnie z mechanizmem zależności między wirusowym genomem, a powstawaniem mRNA (matrycy do syntezy białek)[41].
| Klasa | Oznaczenie | Rodzaj i charakterystyka kwasu nukleinowego | Sposób powstania mRNA[48][49] | Sposób replikacji materiału genetycznego[48][50] | Przykład |
|---|---|---|---|---|---|
| I | dsDNA | dwuniciowy DNA | typowy jak u komórek, odbywa się z udziałem polimerazy RNA zależnej od DNA | replikacja DNA jak u organizmów żywych | adenowirusy, herpeswirusy, pokswirusy |
| II | ssDNA | jednoniciowy DNA | do ssDNA syntetyzowana jest nić komplementarna, aby uzyskać dsDNA; następnie proces jest typowy jak w przypadku dsDNA | formą wyjściową replikacji jest dsDNA | parwowirusy |
| III | dsRNA | dwuniciowy RNA | nici rozwijają się, nić (+)RNA jest wykorzystywana w roli mRNA | na nici (-)RNA jako matrycy powstaje (+)RNA z udziałem wirusowej polimerazy RNA zależnej od RNA | reowirusy |
| IV | (+)ssRNA | jednoniciowy RNA o dodatniej polarności | genom (+)ssRNA wykorzystywany jest jako matryca do syntezy białek | przepisanie genomu na nić (-)RNA, która służy jako matryca do syntezy nowych genomów (+)RNA | pikornawirusy |
| V | (-)ssRNA | jednoniciowy RNA o ujemnej polarności | (-)ssRNA jest przepisywany na komplementarną nić (+)ssRNA z udziałem polimerazy RNA zależnej od RNA, a ta służy jako mRNA | przepisanie genomu na nić (+)RNA, która służy jako matryca do syntezy nowych genomów (-)RNA | ortomyksowirusy, rabdowirusy |
| VI | ssRNA-RT | jednoniciowy RNA, udział odwrotnej transkryptazy (RT) | mRNA transkrybowany jest z DNA, który uprzednio uległ integracji z genomem komórkowym (gospodarza)[51]; genomowy (+)ssRNA nie jest wykorzystywany bezpośrednio jako mRNA[52] | Genomowy (+)ssRNA jest przepisywany do (-)DNA z udziałem odwrotnej transkryptazy, do którego dobudowywana jest nić komplementarna, tworząc dsDNA. Następnie ulega on integracji z genomem komórkowym (gospodarza)[48][50], stając się prowirusem. Może on być replikowany oraz transkrybowany na wirusowy mRNA i genomowy (+)ssRNA[53]. | retrowirusy |
| VII | dsDNA-RT | dwuniciowy DNA, udział odwrotnej transkryptazy (RT) | mRNA transkrybowany jest z DNA[51] | na bazie nici (-)DNA powstaje nić (+)RNA (pgRNA); wykorzystywana jest ona do syntezy genomowego (-)DNA z udziałem odwrotnej transkryptazy, a następnie dobudowywany jest komplementarny (+)DNA | hepadnawirusy |
| Rodzina | Rząd[46] | Genom | Gospodarze[54] | Dodatkowe informacje | Przykładowe choroby wywoływane u ludzi |
|---|---|---|---|---|---|
| parwowirusy | Piccovirales | ssDNA | kręgowce, owady | należą do najmniejszych wirusów; bezosłonkowe, ikozaedralna symetria kapsydu; niektóre mogą namnażać się tylko w obecności wirusów pomocniczych[55] | rumień zakaźny u dzieci – parwowirus B19[55] |
| adenowirusy | Rowavirales | dsDNA | kręgowce | wirion ikozaedralny, brak osłonki[55] | zapalenie spojówek i rogówki, łagodne infekcje układu oddechowego, rzadziej pokarmowego i moczowego[54] |
| papillomawirusy | Zurhausenvirales | dsDNA | kręgowce, niektóre bezkręgowce | przenoszą się przez kontakt bezpośredni, są wytwarzane i gromadzone w obrębie brodawek; mogą rozsiewać się na inne okolice ciała (autoinokulacja)[55] | skórne zmiany rozrostowe (brodawki skórne, kłykciny kończyste), rak szyjki macicy[54] |
| pikornawirusy | Picornavirales | (+)ssRNA | ssaki, ptaki | mały, nieosłonięty ikozaedralny wirion[55] | przeziębienie (rinowirusy), choroba Heinego-Medina, wirusowe zapalenie wątroby typu A (hepatowirus); u zwierząt: pryszczyca[54][55] |
| paramyksowirusy | Mononegavirales | (-)ssRNA | ludzie, psy, koty, foki, delfiny, bydło, ptaki | wykazują duży pleomorfizm[54] | świnka, odra, choroby układu oddechowego; u zwierząt: nosówka[54] |
| herpeswirusy | Herpesvirales | dsDNA | kręgowce, bezkręgowce | zdolność do reaktywacji po okresie utajenia[55]; u człowieka powodują choroby od łagodnych po nowotwory[54] | opryszczka wargowa, ospa wietrzna/półpasiec, mięsak Kaposiego, chłoniak Burkitta (wirus Epsteina-Barr)[54] |
| koronawirusy | Nidovirales | (+)ssRNA | ssaki, ptaki | wywołują sezonowe przeziębienia; z badań przeglądowych przeciwciał wynika, że większość ludzi przebyła w swoim życiu infekcję tymi wirusami[56] | łagodne infekcje układu oddechowego[54] (przeziębienia)[55], SARS, MERS[54], COVID-19[57] |
| ortomyksowirusy | Articulavirales | (-)ssRNA | kręgowce | wirion kolisty lub nitkowaty, osłonka lipidowa z licznymi wypustkami z hemaglutyniny i neuraminidazy[54] | ostre zakażenia układu oddechowego – grypa[54] |
| retrowirusy | Ortervirales | ssRNA-RT | kręgowce | jednoniciowy (+)RNA jest transkrybowany podczas replikacji na dwuniciowy DNA[54] | AIDS (HIV), nowotwory złośliwe wywodzące się z limfocytów T (HTLV)[55] |
| reowirusy | Reovirales | dsRNA | ssaki, ptaki, ryby, owady, rośliny, grzyby | w krajach rozwijających się powodowane przez te wirusy ostre biegunki u niemowląt i małych dzieci należą do ich najczęstszych chorób i są poważną przyczyną ich śmiertelności[54] | ostre nieżyty żołądka i jelit (gastroenteritis) – rotawirusy[54] |
| pokswirusy | Megavirales | dsDNA | naczelne, bydło, psy, koty, gryzonie | powodują powstawanie charakterystycznych grudek z wgłębieniem (kieszonką)[54] | ospa prawdziwa |
| rabdowirusy | Mononegavirales | (-)ssRNA | ssaki, ryby, owady, rośliny | wirion o kształcie pałeczki lub pocisku, otoczony warstwą białek M i lipidową otoczką z wypustkami glikoproteinowymi[54] | wścieklizna |
Kwestia, czy wirusy są żywe, jest dyskusyjna. Odpowiedź na pytanie, czy należy uznać wirusy za organizmy żywe, zależy od przyjętej definicji życia[58]. Z jednej strony wirusy mają zdolność reprodukowania się i adaptacji[59], mają geny i podlegają ewolucji, selekcji naturalnej[60], z drugiej nie mają budowy komórkowej[59], nie przeprowadzają podziałów komórkowych jak prokarioty i eukarioty oraz nie wykazują metabolizmu, są więc zdane wyłącznie na komórkę gospodarzową. Dlatego też nie zalicza się ich do organizmów żywych w ścisłym znaczeniu tego terminu[59]. Według Patricka Forterre można je uznać za żywy twór, ale jedynie podczas wewnątrzkomórkowego cyklu replikacyjnego[1]. Bywają określane organizmami „na krawędzi życia”[61].
Zmienność genetyczna wirusów edytuj
Wirusy wykazują większą różnorodność biologiczną niż królestwo bakterii, roślin i zwierząt razem wzięte[62]. Przykładowo w 2013 roku okazało się, że aż 93% sekwencji kodujących białka u pandorawirusów nie ma homologu (odpowiednika) w ówczesnych bazach danych[63][64]. Nowe choroby wirusowe mogą wyłonić się w wyniku uzyskania zdolności przez pewne wirusy do adaptacji do nowych gospodarzy. Do genetycznych mechanizmów zmienności wirusów należą mutacje, rekombinacje czy reasortacje[65].
Mutacje mogą wiązać się ze zmianą nukleotydu na inny, delecjami i insercjami[66]. Szybciej mutują wirusy RNA niż DNA, oraz zawierające jednoniciowy materiał genetyczny niż dwuniciowy[26]. Związane jest to z niską wiernością polimerazy RNA zależnej od RNA oraz odwrotnej transkryptazy (a więc często popełnianymi przez nie błędami), a także (a może przede wszystkim) brakiem systemu korekty tych błędów (proofreading) u wirusów RNA[67][66].
Rekombinacja może zajść, kiedy co najmniej dwa genomy wirusowe wnikną do komórki[68]. Może być ona homologiczna lub niehomologiczna[69]. Mechanizmy tej rekombinacji w przypadku wirusów DNA są właściwie podobne jak te charakteryzujące DNA komórkowe[70]. Przyjmuje się natomiast, że wirusy RNA przeprowadzają rekombinację w modelu określanym jako „copy choice”[70][71]. Polega on na tym, że podczas replikacji fragment RNA jest syntetyzowany z udziałem polimerazy RNA na nici (matrycy) określanej jako donorowa, a następnie fragment ten wraz z polimerazą przyłącza się do innej nici RNA i to ta nić jest wykorzystywana jako matryca dla dalszej syntezy RNA[71][72].
W przypadku wirusów mających segmentowany genom może nastąpić wymiana tych segmentów pomiędzy wirusami, „przetasowanie”. Jest to określane jako reasortacja[69]. Przykładowo reasortacji mogą ulec fragmenty genomów wirusów grypy ludzkiej, świńskiej, ptasiej, a w efekcie może powstać wirus o nowych właściwościach[65].
Skala zmienności wirusów RNA wynikająca z mutacji i rekombinacji jest na tyle duża, że uważa się, że istnieją one jako mieszanina bardzo wielu genetycznych wariantów (tzw. quasi-species)[66][68]. W organizmie gospodarza tworzy się układ dynamiczny, w którym zwykle jeden wariant dominuje, ale pozostałe także są obecne[66]. Zmiany genetyczne mogą prowadzić do powstania nowych szczepów wirusa o odmiennych właściwościach antygenowych[72].
Gospodarze wirusów edytuj
Zwierzęta są gospodarzami dla wielu wirusów, często bardzo podobnych do ludzkich, ale niezdolnych do wywołania u człowieka objawów chorobowych. Jednak część z nich w wyniku przemian genetycznych może potencjalnie przystosować się do różnych gospodarzy, w tym człowieka. Dlatego przy badaniach epidemiologicznych nad infekcjami wirusowymi człowieka oraz nad nowymi odmianami wirusów bierze się pod uwagę również rezerwuar wirusów zwierzęcych[73].
Przykładowo świnie mają receptory dla ludzkich (i ptasich) szczepów wirusa grypy[74]. Zdarzają się zakażenia ze świń na człowieka i odwrotnie, z człowieka na świnie (por. świńska grypa, ptasia grypa)[75]. Z kolei dla pewnych innych wirusów gospodarzem może być tylko jeden określony gatunek. Przykładowo wirus polio, wirus różyczki, świnki, odry, ospy wietrznej infekuje tylko człowieka[75]. Nawet w obrębie danego gatunku gospodarza wiele wirusów infekuje tylko określone typy komórek lub tkanek wielokomórkowego organizmu[76].
Jeszcze inne wirusy muszą zarażać różnych gospodarzy, aby utrzymać się w naturze. Należy do nich wirus żółtej febry i wirus dengi. Wirusy te infekują ludzi, ale rzadko przenoszą się bezpośrednio z człowieka na człowieka. Najczęściej przenoszone są z komarów na ludzi. Tego typu wirusy rozprzestrzeniane za pośrednictwem owadów noszą zbiorczą nazwę arbowirusów[75].
Wirus dąży do utrwalenia się w populacji gospodarzy, aby zapewnić sobie namnażanie[63]. Dlatego też generalnie nie odnosi korzyści z zabicia swojego gospodarza, wręcz przeciwnie, jest mu on niezbędny do przetrwania[77]. Jeśli powiązanie danego wirusa z danym gospodarzem trwa długo, to najczęściej relacja ta ewoluuje w taki sposób, że gospodarz ponosi niewielkie straty z powodu zakażenia. Kiedy jednak wirus rozszerza zakres swoich gospodarzy, świeżo nabierając zdolności do infekowania nowego rodzaju gospodarza, wówczas często jest znacznie bardziej zjadliwy dla niego w porównaniu ze starym gospodarzem. Przykładowo wirus myksomatozy, dla którego naturalnym gospodarzem jest pewien gatunek królika z Ameryki Południowej, powoduje u niego łagodne objawy chorobowe, które ostatecznie ustępują. Ten sam wirus u królika europejskiego powoduje rozwój niemal zawsze śmiertelnej w skutkach myksomatozy. Wydaje się, że ostatecznym wynikiem takiej koewolucji jest zintegrowanie się na stałe genomu wirusa do genomu gospodarza. Taki stan osiągnęły retrowirusy endogenne[78].
Termin emerging virus ([nowo] pojawiający się wirus) jest używany w odniesieniu do wirusa, który niedawno nabrał zdolności do infekowania gospodarza nowego gatunku, do wirusa, który pojawił się (i utrwalił swoją obecność) w części świata, gdzie dotychczas nie występował, lub do wirusa, którego dotyczą obie te właściwości[79]. Nabranie tych zdolności jest możliwe w wyniku mutacji czy rekombinacji genetycznych (w tym reasortacji). Najprawdopodobniej wirus ospy prawdziwej i odry wyewoluował z wirusów bydła, ludzki wirus grypy z wirusów kaczek i świń, a HIV z małpiego wirusa niedoboru odporności[80]. Wirus Zachodniego Nilu znany jest od 1937, pojawił się w regionie Zachodniego Nilu w Ugandzie. Dla Ameryki Północnej stał się takim emerging virus w 1999, kiedy po raz pierwszy odnotowano tam jego obecność[81] i zaczął się na tym terenie rozpowszechniać. Dlatego też [nowo] pojawiające się wirusy nie są wirusami całkowicie nowymi[80].
Etapy cyklu replikacyjnego wirusów edytuj
Nowe wiriony powstają w procesie replikacji w komórce gospodarzowej w wyniku powielania komponentów wirusa i ich złożenia. Nigdy nie powstają bezpośrednio z innego wirionu[82], nie zachodzi tu podział jak w przypadku komórek[83]. Wirusy korzystają z komórkowych składników budulcowych (jak aminokwasy, nukleotydy), maszynerii do syntezy białek (rybosomów) oraz energii (ATP)[82]. Są zatem wewnątrzkomórkowymi pasożytami bezwzględnymi[84], to znaczy są całkowicie zależne od żywych komórek pełniących rolę ich gospodarza[85]. Zmieniają jednak wewnątrzkomórkowe środowisko i podporządkowują sobie komórkę w taki sposób, aby efektywniej się replikować[82].
Infekcja komórki wirusem kończąca się wytworzeniem potomnych wirusowych cząstek nazywa się infekcją produktywną. Powielanie się wirusów przebiega etapowo. Poszczególne etapy w zależności od typu komórki gospodarza, organizacji i ekspresji wirusowych genów mogą wykazywać w rozmaitych wirusach pewne różnice[83].
W cyklu replikacyjnym wyróżnia się następujące etapy:
- adsorpcja (przyczepienie się) wirusa do komórki;
- penetracja (wnikanie do komórki)[86];
- powielanie komponentów wirusa – transkrypcja genów do mRNA, translacja wirusowego mRNA prowadząca do powstania wirusowych białek, replikacja genomu[87];
- składanie cząstek wirusowych (wirionów);
- uwalnianie potomnych wirionów z komórki[86].
Wirusy mogą namnażać się wyłącznie we wnętrzu komórek gospodarza, są od niego całkowicie uzależnione, a ścisły związek z jego metabolizmem tłumaczy, dlaczego wirusy mogą atakować tylko określone organizmy, a w ich obrębie tylko pewne określone typy komórek[88], np. wirus zapalenia wątroby typu B może się replikować tylko w komórkach wątrobowych[89]. Tworzone przez nie białka transportowe czy enzymy muszą być kompatybilne z cząsteczkami w komórkach gospodarza[88]. Komórki, w których geny wirusa ulegają prawidłowej ekspresji i zachodzą wszystkie etapy cyklu życiowego wirusa nazywają się komórkami permisywnymi, a ich cykl replikacyjny określany jest cyklem produktywnym. Niektóre wirusy dla replikacji wymagają odpowiedniej fazy cyklu komórkowego, np. retrowirusy fazy M (mitozy), a parwowirusy fazy S (syntezy)[89].
Aby infekcja była skuteczna, komórka musi zarówno mieć odpowiednie receptory, jak i być permisywną[90]. Cząstki wirusa muszą mieć też zapewniony do niej fizyczny dostęp[91] – infekcję wirusową zapoczątkowuje przypadkowe zderzenie się wirionu z wrażliwą na zarażenie nim komórką. Im więcej wirionów, tym większe jest prawdopodobieństwo takiego zdarzenia[90]. Warunkiem jest także uporanie się z mechanizmami układu odpornościowego gospodarza[91]. Infekujący wirus musi przekroczyć baterię błony cytoplazmatycznej, a w niektórych przypadkach także błony jądrowej. Wprowadzony materiał genetyczny musi znaleźć się z odpowiednim miejscu komórki, a potomne wirusy muszą być odpowiednio zabezpieczone, aby przetrwać w środowisku pozakomórkowym[90].
Rozpoznanie i adsorpcja edytuj
Prawie każdy typ komórki ludzkiej czy zwierzęcej może być potencjalnie zainfekowany przez jeden a zwykle wiele gatunków wirusa[92]. Warunkiem jest adsorpcja – rozpoznanie i przyczepienie cząstek wirusowych do powierzchni określonych komórek[93], które mają swoiste receptory powierzchniowe[94].
Praktycznie wszystkie cząstki wirusów mają na swojej powierzchni[92] (tj. na powierzchni kapsydu lub osłonki, jeśli ją mają)[94] takie struktury, zwykle białka, które pośredniczą w przyłączaniu się do odpowiedniego receptora na powierzchni komórki gospodarza. Większość takich struktur jest kodowana przez genom wirusa, ale niektóre (jak cząsteczki adhezyjne, proteoglikany) mogą pochodzić z komórki gospodarza[92]. W oddziaływaniach wirus-receptor biorą udział wiązania jonowe, wodorowe i oddziaływania van der Waalsa[93].
Zdarza się, że jeden typ wirusa może wiązać różne receptory, a receptor może być specyficzny dla wielu wirusów. Czasami w celu wniknięcia do komórki potrzebny jest dodatkowo koreceptor, np. HIV potrzebuje oprócz receptora CD4 dodatkowych koreceptorów CCR5 lub CXCR4[93].
Środowisko, w którym wirusy próbują przyłączyć się do komórek często jest dla nich nieprzyjazne[92], dlatego mogą korzystać z innych czynników umożliwiających adsorpcję do komórki (ang. attachment factors), o niskiej specyficzności[93]. Przykładowo pierwszą fizyczną strukturą, jaką napotkać mogą wirusy, zbliżając się do powierzchni komórki, jest glikokaliks, a w nim nadające mu ładunek proteoglikany[92]. Wchodzące w ich skład glikozaminoglikany mogą służyć jako takie czynniki. Przykładowo siarczan heparanu może być wykorzystywany przez wirus brodawczaka ludzkiego. Innym takim czynnikiem jest kwas sjalowy wykorzystywany m.in. przez wirus grypy[93].
Rozpoznanie specyficznego receptora/receptorów na powierzchni komórki potencjalnego gospodarza przez wirusa umożliwia kolejny etap infekcji – penetrację do wnętrza komórki[95]. Wyjątkiem pod względem powyższych mechanizmów są wirusy roślinne i wirusy grzybów, które do przedostania się do wnętrza komórek nie wymagają receptora, infekują, korzystając z mechanicznych uszkodzeń[95].
Penetracja edytuj
W przypadku wirusów zwierzęcych i roślinnych do komórki gospodarza wnika na ogół cały wirion lub przynajmniej nukleokapsyd[96]. Wirus zwierzęcy wnika do komórki generalnie na dwa sposoby – przez bezpośrednią fuzję osłonki wirusa z błoną komórkową albo przez endocytozę (większość wirusów). W przypadku endocytozy uwalnianie wirusów zależy od tego, czy mają osłonkę, czy nie. Gdy nie mają, ważną rolę odgrywa niskie pH i liza pęcherzyka endocytarnego lub tworzenie porów w błonie endosomów. Jeśli wirusy zawierają osłonkę, nukleokapsyd jest zwykle uwalniany do cytoplazmy poprzez fuzję między osłoną wirusa a błoną endosomalną. Fuzję tę powoduje niskie pH wewnątrz endosomów aktywujące peptydy fuzyjne w glikoproteinach osłonki[97]. Można wyróżnić kilka rodzajów endocytozy, które wykorzystują wirusy: endocytoza zależna od klatryny, endocytoza zależna od kaweoliny, endocytoza niezależna od klatyn ani kaweolin, makropinocytoza, fagocytoza[97].
Wyjątkowo niektóre bezotoczkowe wirusy zwierzęce (niektóre pikornawirusy) potrafią tworzyć pory w błonie komórkowej i przez nie wprowadzać swój materiał genetyczny do wnętrza komórki[97]. Taka metoda „wstrzykiwania” kwasu nukleinowego do komórki gospodarza charakterystyczna jest dla niektórych bakteriofagów[98][99]. Do komórki wnika wirusowy genom (i ewentualnie pewne białka), natomiast kapsyd i inne związane z nim struktury pozostają na zewnątrz[96].
Podczas replikacji pewnych wirusów w komórkach gospodarza powstają tzw. ciałka wtrętowe. Stanowią one skupiska wirusowych kwasów nukleinowych i/lub białek, wirionów bądź produktów degeneracji komórki[100].
Powielanie komponentów, składanie i uwalnianie cząstek wirusowych edytuj
W przypadku wirusów eukariotów większość wirusów RNA replikuje się w cytoplazmie, a wirusy DNA, z wyjątkiem pokswirusów i irydowirusów, w jądrze komórkowym. W celu przedostania się do jądra komórkowego wirusy muszą pokonać kolejną barierę – otoczkę jądrową. Jej pory wielkości 25 nm pozwalają na wniknięcie tylko małych wirusów. Większość ulega uprzedniemu odpłaszczeniu i do jąder dociera tylko materiał genetyczny wirusa wraz z białkami niosącymi sygnał lokalizacji jądrowej. Niektóre, jak wirus brodawczaka ludzkiego, mają możliwość dostać się do jądra jedynie podczas mitozy, kiedy otoczka jądrowa ulega fragmentaryzacji[101].
Po wykorzystaniu maszynerii komórkowej do produkcji wirusowych białek i kwasu nukleinowego komórka może być we względnie normalnym stanie lub też może być nieodwracalnie uszkodzona. Następuje składanie cząstek wirusowych – niektóre (np. wirus polio) są składane w cytoplazmie, inne (np. adenowirusy) głównie w jądrze[102]. Zazwyczaj kapsyd wytwarzany jest pierwszy[99]. Składanie kapsydu wokół wirusowego kwasu nukleinowego nazywane jest enkapsydacją[103].
Zdarza się, że do wirionów pakowane są także komórkowe kwasy nukleinowe. Przykładowo do wirionów retrowirusów mogą trafiać różne komórkowe RNA, m.in. tRNA, który pełni ważną rolę przy infekowaniu kolejnej komórki. Jednak w większości przypadków komórkowe kwasy nukleinowe nie wchodzą do składanego wirionu. U niektórych wirusów sygnałem do pakowania (który pozwala na selekcję) jest obecność odpowiedniej sekwencji nukleotydowej. W przypadku jednoniciowego genomu może to być pewna struktura drugorzędowa. Wiele wirusów o jednoniciowym genomie pakuje nić albo o polarności ujemnej, albo dodatniej, więc sygnał musi występować tylko na jednym z tych rodzajów nici. Wirusowy genom musi być umieszczony w małej przestrzeni, dlatego odpychające się ładunki ujemne z grup fosforanowych muszą zostać zneutralizowane. Służą temu dodatnio naładowane białka zasadowe (np. kodowane przez wirusa lub pochodzenia komórkowego – histony) albo inne związki (np. poliaminy, kationy)[104].
Niektóre wirusy, zwłaszcza o prostych wirionach, mogą składać się „samodzielnie”. Polega to na tym, że potrafią złożyć się w probówce (przy odpowiednim pH i obecności pewnych jonów) ze składowych białek i kwasu nukleinowego. Inne zaś do złożenia wymagają środowiska wewnątrzkomórkowego, mogą być im niezbędne pewne białka obecne tylko przejściowo, nieobecne w dojrzałym wirionie, stanowiące swego rodzaju rusztowanie[105].
Następnie wirusy potomne są uwalniane z komórki. Bezotoczkowe wirusy zwykle uwalniają się po śmierci i rozpadzie komórki (liza). Rozpad ten może być zainicjowany przez wirusa. Może on produkować enzymy takie jak lizozym przerywający ścianę komórkową bakterii. Inną strategią jest produkcja białek hamujących działanie komórkowych enzymów związanych z syntezą ściany komórkowej, a w konsekwencji osłabienie jej doprowadzające ostatecznie do jej przerwania[106]. Wirusy otoczkowe natomiast pączkują z komórki, a ich otoczka pozyskiwana jest na ogół z błony komórkowej gospodarza. U pewnych wirusów jest syntetyzowana de novo na późnym etapie cyklu replikacyjnego[106].
Wirusy po opuszczeniu komórki pozostają na ogół nieaktywne i bierne aż do napotkania kolejnego gospodarza. Znane są jednak przypadki, kiedy wiriony po opuszczeniu gospodarza ulegają jeszcze pewnym morfologicznym zmianom, zachodzi ich dojrzewanie[106]. Złożony wirion jest nośnikiem mającym przekazać wirusowy genom kolejnej komórce lub organizmowi. Tam ulega demontażowi i rozpoczyna kolejny cykl infekcyjny[107].
Wybrane grupy wirusów edytuj
Wirusy roślinne edytuj
Komórki roślinne są otoczone ścianą komórkową stanowiącą dość dobrą barierę przed wniknięciem wirusa[108]. Dlatego też infekcje wirusowe roślin zachodzą głównie przez mikrouszkodzenia ścian komórkowych, często za pośrednictwem wektorów, czyli organizmów żerujących na roślinach, np. mszyc. Poza tym wirusy mogą być przenoszone przez nasiona, pyłek, rozmnażanie wegetatywne i szczepienie roślin (wszczepianie zraza w podkładkę)[109].
Infekcje wirusowe zwiększają podatność roślin na mróz, suszę, atak innych patogenów i szkodników, obniżają plony, niekorzystnie wpływają na wygląd i smak owoców. Powodują duże straty w przemyśle spożywczym i rolnictwie. U większości wirusów roślinnych występuje (+)ssRNA, tzn. genom może być wykorzystany bezpośrednio jako mRNA w procesie translacji. Zwykle nie mają otoczki białkowo-lipidowej (do wyjątków należą wirus brązowej plamistości pomidora TSWV i wirus siateczkowatej żółtaczki mlecza SYNV)[109].
Wirusy przy przemieszczaniu się w roślinach korzystają z dróg i mechanizmów używanych przez rośliny do transportowania substancji. Przy przemieszczaniu się z komórki do komórki wykorzystują plazmodesmy – roślinne połączenia międzykomórkowe, oraz kodowane przez własny wirusowy genom białka transportowe[110]. Jest to jednak proces powolny. W transporcie długodystansowym wirusy wykorzystują wiązki przewodzące, przede wszystkim łyko[111].
Nawet jeśli wirusy opanują całą roślinę, komórki merystematyczne, a zwłaszcza komórki stożków wzrostu, są z reguły wolne od wirusów. Wykorzystuje się to w procesie uwalniania roślin od wirusów, kiedy takie wycięte fragmenty hoduje się na sztucznych pożywkach i odtwarza roślinę[112].
Wirusy organizmów prokariotycznych edytuj
Wirusy infekujące organizmy prokariotyczne (bakterie, archeony) nazywane są fagami (a w przypadku, gdy gospodarzem są bakterie, można też je określać bakteriofagami)[113].
Fagi mogą mieć genom o zróżnicowanym rozmiarze w formie DNA lub RNA[113], ale większość bakteriofagów zawiera dwuniciowy DNA (dsDNA)[114]. Trudno jest znaleźć jakiekolwiek cechy wspólne w budowie dla wszystkich reprezentantów tej grupy. Charakterystyczne są trzy rodziny bakteriofagów należące do rzędu Caudovirales. Wirusy z tego rzędu zbudowane są z główki o symetrii ikozaedru (czasem zniekształconego) zawierającej materiał genetyczny, i ogonka o rurkowatej strukturze, zbudowanego z helikalnie lub warstwowo ułożonych podjednostek. Z zakończenia ogonka zwykle wystają białkowe włókienka i/lub wypustki[113].
Podobnie jak w przypadku innych wirusów, fagi muszą rozpoznać odpowiednią komórkę, adsorbować się na jej powierzchni i wprowadzić do jej cytoplazmy swój materiał genetyczny. Wiele z nich zawiera enzymy zdolne do rozkładu ściany komórkowej, niektóre mogą wykorzystywać pile bakterii[113].
Wyróżnić można trzy podstawowe modele cyklu replikacyjnego tych wirusów:
- cykl lityczny – wirus gwałtownie namnaża się w zarażonej komórce, prowadząc do jej lizy (śmierci)
- cykl lizogeniczny – genom faga integruje się z genomem komórki bakterii lub archeona, utrzymywany jest częściowo w nieaktywnej formie (profag); replikuje się wraz z materiałem genetycznym gospodarza
- cykl chroniczny – wirus namnaża się w zainfekowanej komórce, ale nie prowadzi do jej lizy. Wiriony są wydalane poza komórkę przez specjalne kompleksy białkowe[113].
Bakteriofagi regulują liczebność i rozmieszczenie bakterii. W celu ochrony przez infekcją bakterie wykształciły system restrykcji i modyfikacji[115] oraz CRISPR[116] degradujący obcy DNA. W odpowiedzi pewne fagi nabrały zdolności, aby tej degradacji uniknąć[115].
Wirusy owadzie edytuj
Owady mogą pełnić funkcję gospodarzy wirusów lub wektorów, zarówno wirusów zwierzęcych, jak i roślinnych. Owadzie wirusy są bardzo zróżnicowane pod względem strukturalnym i genetycznym. Niektóre mogą się namnażać w owadzich komórkach, nie powodując chorób, inne są silnie patogeniczne i doprowadzają do śmierci owada. Niektóre z nich, zwłaszcza bakulowirusy (które w większości zakażają tylko stadia larwalne owadów) i nudiwirusy, mogą być stosowane w ramach biologicznego zwalczania szkodników roślin. Wirusy owadzie nie są zdolne do zakażania komórek ludzkich[117].
Wirusy o innych gospodarzach edytuj
Większość wirusów grzybów zawiera dwuniciowy RNA (dsRNA)[31]. Infekcje wirusów zakażających grzyby w wielu przypadkach wywołują niewielkie zmiany na gospodarzu lub wcale ich nie wywołują. Bywa, że wirusy te zmniejszają zjadliwość niektórych grzybów powodujących choroby roślin. Wirusy mogą także infekować glony, co wpływa na zakwity i dynamikę populacji fitoplanktonu[118].
Cząstki subwirusowe edytuj
Wirusy satelitarne oraz satelitarne RNA (satRNA) charakteryzują się tym, że wymagają do namnażania obecności innego wirusa, tzw. wirusa pomocniczego. Różnica między wirusami satelitarnymi a satRNA polega na tym, że te pierwsze kodują białka kapsydu, a te drugie korzystają z białek kapsydu wirusa pomocniczego. Wirusy satelitarne i większość satRNA utrudnia namnażanie wirusa pomocniczego[119].
Podczas replikacji wirusów RNA mogą zdarzyć się pewne nieprawidłowości w kopiowaniu genomu wirusowego[120], delecje[119], które powodują, że nie koduje on wszystkich niezbędnych białek wirusowych[120]. Jest to tzw. defektywne RNA (defective RNA, D-RNA)[119]. Do zapewnienia brakujących białek potrzebna jest obecność wirusa rodzicielskiego (nazywanego tu także wirusem pomocniczym)[120].
Cząstki defektywnego RNA zwykle nie zakłócają replikacji wirusa pomocniczego; te które zakłócają[119], łagodzą objawy zakażenia[120], nazywane są defektywnym interferującym RNA (DI RNA)[119]. Satelitarny RNA różni się od defektywnego tym, że nie wykazuje dużych podobieństw w sekwencji nukleotydów z genomem odpowiedniego wirusa pomocniczego i jego pochodzenie pozostaje niepewne[120].
Wiroidy stanowią małe, koliste cząsteczki jednoniciowego RNA (ssRNA). W przeciwieństwie do wirusów nie są obudowane kapsydem, są nagie i nie kodują żadnych białek. Infekują wyłącznie rośliny i prawdopodobnie wywołują interferencję RNA z istotnymi mechanizmami molekularnymi gospodarza[121].
Wirofagi to wirusowe pasożyty gigantycznych wirusów[122]. Pierwszy odkryty wirus o takich właściwościach nazwano sputnikiem; kolejne to mawirus oraz wirofag Jeziora Organicznego (OLV, od ang. Organic Lake virophage)[123].
Infekcje wirusowe edytuj
Następstwa zakażenia wirusowego komórki gospodarza edytuj
Interakcje wirus-komórka można podzielić na cytolityczne, przewlekłe, utajone, wywołujące transformację nowotworową i nieefektywne. Dany wirus w różnych typach komórek może wykazywać różne typy interakcji. Warunkiem zajścia jakiejkolwiek infekcji jest wiązanie wirusa z receptorem na powierzchni komórki gospodarza – bez tego komórka jest odporna na zakażenie[124].
W następstwie zakażenia wirusowego komórki gospodarza może zajść:
- Zniszczenie komórki (martwica, zakażenie cytolityczne) – infekcja doprowadza ostatecznie do destrukcji komórki. Jednakże podstawowym celem działań wirusa jest nie tyle uśmiercenie komórki, co podtrzymywanie własnej replikacji. Zmiany morfologiczne i degeneracyjne wywołane przez wirus w hodowlach komórkowych określa się efektem cytopatycznym. W ramach tych zmian zaobserwować można zaokrąglenie komórek, oderwanie się ich od komórek sąsiednich bądź podłoża, tworzenie wielojądrowych komórek olbrzymich, pojawienie się wakuoli w cytoplazmie, tworzenie ciałek wtrętowych. Niektóre wirusy, przejmując kontrolę nad komórką, mogą częściowo lub całkowicie zahamować syntezę nieprzydatnych dla nich makrocząsteczek komórkowych, aby zwiększyć wydajność swojej replikacji. Poza tym pod wpływem pewnych zmian same komórki mają możliwość zainicjowania samodestrukcji – apoptozy[125]. W przeciwieństwie do martwicy, w tym przypadku nie jest uwalniana zawartość komórki, która wyzwalałaby procesy zapalne. Apoptoza może być procesem obronnym, jeśli komórka „popełnia samobójstwo” w celu zapobieżenia wytwarzania potomnych cząstek wirusowych. Niektóre wirusy same zapoczątkowują proces apoptozy, a następnie w pewnym punkcie ją zatrzymują, kontynuując swoją replikację[126].
- Zakażenie przewlekłe – zachodzi ciągłe wytwarzanie wirusa, co jest spowodowane tym, że zainfekowana komórka przeżywa, wirus nie niszczy komórki (zakażenie nielityczne), albo rozprzestrzenianie się wirusa jest ograniczone, przez co śmierć komórek jest równoważona pojawianiem się nowych komórek w wyniku podziału, i netto nie zachodzą straty. Na zachowanie równowagi mogą mieć wpływ także przeciwciała i interferon. Zakażenie przewlekłe może także wynikać z zahamowania przez wirusa apoptozy komórki[77].
- Zakażenie utajone (latentne) – genom wirusa jest obecny w komórce, może ulec integracji (tzw. prowirus[127]; u bakteriofagów – profag)[32], ale komórka nie jest niszczona ani nie występują objawy chorobowe[125]. Wirusowy genom może być całkowicie wyłączony albo niektóre geny mogą ulegać ekspresji w postaci białek czy niekodującego RNA[128]. Nie są wytwarzane potomne wiriony[125][127], ale kiedy zainfekowana komórka się dzieli, genom wirusa również ulega replikacji i jest obecny w komórkach potomnych[127][128]. Ten typ infekcji jest charakterystyczny dla herpeswirusów i adenowirusów[129]. Wirusy chronione są w ten sposób przed działaniem układu immunologicznego[125], jest to rodzaj strategii, by pozostać w komórkach gospodarza przez długi czas (w przypadku herpeswirusów u ludzi – na całe życie)[129]. Pod wpływem różnych czynników wirusy mogą się reaktywować, przechodząc do aktywności cytolitycznej[125][129].
- Transformacja nowotworowa – w wyniku infekcji pewnymi wirusami DNA i niektórymi retrowirusami komórka może zacząć dzielić się szybciej od pozostałych[130], podlegając przy tym różnym zmianom, m.in. morfologicznym, metabolicznym, ulegając transformacji nowotworowej[125]. Często proces ten poprzedzony jest integracją co najmniej części genomu wirusowego z genomem gospodarza[129]. Takie wirusy bywają nazywane onkogennymi[131]. Mogą one zmieniać ekspresję protoonkogenów, genów supresorowych i innych[132]. Wirusy onkogenne normalnie wywołują zakażenia cytolityczne lub przewlekłe, transformacja nowotworowa jest wydarzeniem rzadkim[133], nie jest potrzebna wirusowi do namnażania[134][d], jednak może być brzemienna w skutkach dla gospodarza[133]. Szacuje się, że wirusy odpowiadają za 15–20% wszystkich nowotworów w populacji ludzkiej[136].
- Zakażenie nieproduktywne (ang. abortive infection) – zakażenie komórki, w której wirus replikuje się nieefektywnie (czasem wcale się nie replikuje) lub produkuje cząstki potomne wadliwej jakości[137].
Zakażenie organizmu edytuj
Ogólne objawy infekcji wirusowej są podobne to tych kojarzonych często z przeziębieniem: podwyższona temperatura, złe samopoczucie, dreszcze, bóle mięśniowe. Niektóre zakażenia wirusowe dają objawy specyficzne, co może być związane bezpośrednio z tropizmem tkankowym, zjadliwością szczepu czy stanem odpornościowym pacjenta[138].
Mylone bywają pojęcia zakażenia wirusowego i choroby (zachorowania) o etiologii wirusowej. Zakażenie (infekcja) wiąże się ze wszystkimi następstwami wniknięcia wirusa do wrażliwej komórki, niezależnie od tego, czy dojdzie w ogóle do wystąpienia klinicznych objawów choroby. Choroba wirusowa (zachorowanie) jest stanem zainfekowanego organizmu, kiedy dochodzi do wystąpienia klinicznych objawów, co wiąże się z czasowym lub trwałym upośledzeniem fizjologicznych czynności komórek, tkanek i narządów[139].
Czas, który upływa do wystąpienia pierwszych objawów nazywany jest okresem wylęgania lub inkubacji. Jest on ważny z punktu widzenia epidemiologii, profilaktyki i diagnostyki. Krótki okres inkubacji (2–3 dni) charakterystyczny jest dla zakażeń, w których niewielka jest odległość między miejscem wejścia wirusa a komórkami docelowymi (co często dotyczy wirusów atakujących układ oddechowy), ale nie jest to jedyny wpływający na to czynnik. Czasami jedno zakażenie może skutkować wielokrotnym wystąpieniem objawów chorobowych (remisja, nawrót)[139].
Zakażenia wirusowe można podzielić na objawowe i bezobjawowe. Zakażenia bezobjawowe to takie, w których nie stwierdza się wystąpienia objawów chorobowych, ale można wykazać obecność wirusa w różnych komórkach, wydzielinach, płynach ustrojowych, oraz obecność swoistych reakcji immunologicznych, które potwierdzają infekcję. Tego typu zakażenia występują bardzo często, w przypadku niektórych wirusów stanowią większość. Przykładowo przed prowadzeniem masowych szczepień przeciw wirusowi polio, zakażenia bezobjawowe stanowiły nawet 99% przypadków. W krajach nieobjętych szczepieniami lub objętych w ograniczonym zakresie stosunek liczbowy zakażeń objawowych i bezobjawowych w przypadku wirusa różyczki jest zależny od okresu epidemiologicznego i waha się między 1:1 a 1:7[140].
W konsekwencji zdecydowana większość osób nie zdaje sobie sprawy, że przeszła lub przechodzi bezobjawowe zakażenie wirusowe. Takie zakażenie może zostać zwalczone i pozostawiać odporność, ale może być także początkiem choroby przewlekłej. Zasiedlony wirus może być utrzymywany w stanie równowagi dzięki mechanizmom układu odpornościowego. Zarówno zakażenia bezobjawowe, jak i objawowe mogą zapoczątkować zakażenia utajone (latentne), które później wskutek okresowego osłabienia odporności mogą się ujawnić, powodując czasem nawet wielokrotne nawroty choroby. Zakażenia wirusem opryszczki pospolitej są typowym przykładem utajonej postaci zakażenia przewlekłego[140].
Ze względu na rozsiew wirusów w organizmie można wyróżnić dwa rodzaje zakażeń:
- zakażenie miejscowe – wirusy przenoszą się z komórki do komórki, namnażają się wyłącznie we wrotach zakażenia i tkankach bezpośrednio sąsiadujących z nimi – do nich ograniczone jest zakażenie oraz objawy chorobowe. Przykładowo rinowirusy namnażają się wyłącznie komórkach górnych dróg oddechowych;
- zakażenie uogólnione – wirusy początkowo namnażają się we wrotach zakażenia, a następnie rozsiewają się przez naczynia krwionośne[141] (stan wiremii[142]), limfatyczne lub przez układ nerwowy do narządów docelowych. Może się to odbywać bezpośrednio lub po zakażeniu dodatkowego narządu. Przykładowo enterowirusy namnażają się w nabłonku jelitowym, ale nie wywołują tam objawów chorobowych. Należące do tego rodzaju poliowirusy i echowirusy wywołują chorobę dopiero po dotarciu do ośrodkowego układu nerwowego, a w przypadku wirusów Coxsackie – do mięśni[141].
Kierunki szerzenia się wirusów mogą być różne. W przypadku wirusa wścieklizny odbywa się to z pierwotnego ogniska zakażenia wzdłuż włókien nerwowych do ośrodkowego układu nerwowego, a w przypadku wirusa opryszczki pospolitej ze zwojów nerwowych, w których znajdują się w stanie latentnym, do narządu docelowego[141]. Dlatego też funkcjonuje umowny, kliniczny podział wirusów (przy czym wirusy nie zawsze należą tylko do jednej grupy):
- pneumotropowe – wywołują zakażenia dróg oddechowych
- neutrotropowe – infekują ośrodkowy układ nerwowy
- enterotropowe – namnażają się w komórkach jelit, zakażają szereg narządów wewnętrznych
- pantropowe – powodują infekcje całego organizmu (np. wirus odry, świnki)
- onkogenne – mogą wywołać nowotwory[142].
Sama obecność wirusów w ustroju ma działanie szkodliwe dla organizmu, ponieważ białka wirionów wykazują działanie toksyczne[142].
Najważniejszymi wrotami zakażenia dla wirusów są błony śluzowe układu oddechowego (tzw. droga kropelkowa) i pokarmowego oraz uszkodzona skóra (mikrourazy lub inokulacja mechaniczna)[141]. Zakażenie może się odbywać drogą płciową, a także przez łożysko[143] lub mleko (transmisja wertykalna, z matki na dziecko). W zakażeniu mogą pośredniczyć wektory, np. owady żywiące się krwią czy kleszcze. Osobnym źródłem zakażeń są transfuzje krwi, zabiegi operacyjne czy iniekcje[144].
Odpowiedź komórek i organizmów zwierzęcych na zakażenia wirusowe edytuj
W organizmach zwierzęcych (w tym człowieka) pierwszą linią obrony przed wirusami jest bariera fizyczna w postaci skóry czy nabłonka jelit, a ponadto bariera chemiczna jak sok żołądkowy z kwasem solnym. Drogi oddechowe są wyściełane śluzówką, która w wielu przypadkach zapewnia skuteczną ochronę przed patogenami. Niektóre jednak, jak wirusy grypy, ułatwiają sobie pokonanie jej przez wydzielanie enzymu neuraminidazy[145].
Następnie pojawia się nieswoista odpowiedź immunologiczna, w której bardzo ważną rolę pełnią interferony; biorą w niej udział takie mechanizmy jak zmiany pH i równowagi jonowej oraz podwyższenie temperatury ciała[146]. Ponadto w tej odpowiedzi uczestniczą inne komórkowe i niekomórkowe elementy odporności wrodzonej[145], m.in. komórki NK. Dopiero po tej odpowiedzi następuje wolniejsza odpowiedź nabyta, swoista, związana z rozpoznaniem obcego antygenu, oparta na limfocytach B i T[145]. W związku z mechanizmami pamięci immunologicznej zakażenia wywoływane po raz kolejny przez ten sam typ wirusa mają zwykle lżejszy przebieg, w krwi gwałtownie rośnie wówczas poziom odpowiednich przeciwciał. Najbardziej trwałą odporność na zakażenia wtórne pozostawiają wirusy powodujące wiremię i zakażenia poszczególnych narządów, natomiast krótkotrwałą – wirusy namnażające się tylko w nabłonku i najbliższych węzłach chłonnych (np. wirus grypy, wirusy związane z przeziębieniem)[147].
Stosunkowo niedawnym odkryciem jest przeciwwirusowa wewnętrzna odpowiedź komórki na zakażenie wirusowe. Polega ona na wyciszaniu epigenetycznym genomu wirusowego i mechanizmie interferencji RNA[145].
Wirusy w toku ewolucji wykształciły mechanizmy przeciwstawiania się odpowiedzi odpornościowej organizmów. Niektóre wirusy, jak wirusy grypy, szczególnie często ulegają zmianom genetycznym, które powodują, że są nierozpoznawane przez wcześniej wytworzoną specyficzną odpowiedź immunologiczną skierowaną przeciw nim. Polega to na zmienności antygenowej[148], której znane są dwa rodzaje – skok antygenowy i przesunięcie antygenowe[149]. Pewne wirusy zakłócają zdolność komórek do prezentacji antygenu, zmniejszają syntezę interferonu, tłumią lub wykorzystują na własną korzyść takie mechanizmy jak apoptoza czy autofagia. Niektóre namnażają się w tkankach bądź narządach, które nie są łatwo dostępne dla systemu odpornościowego, np. w mózgu. Mogą też „ukryć się” przed odpowiedzią immunologiczną, przechodząc w stan latencji (utajenia)[148].
Znaczenie medyczne edytuj
Leki przeciwwirusowe edytuj
Wirusy korzystają z mechanizmów metabolicznych gospodarza. Większość leków przeciwwirusowych oddziałuje na replikację wirusów, co siłą rzeczy wpływa także na komórki gospodarza (problem z wybiórczym działaniem leków)[150], a poza tym sprawia, że większość tych leków jest skutecznych jedynie, gdy są one podane w krótkim czasie po zakażeniu. Wymaga to bardzo szybkiego rozpoznania, tymczasem objawy pojawiają się najczęściej dopiero na etapie namnażania wirusa[151]. Większość leków przeciwwirusowych jest też specyficzna względem jednego bądź kilku rodzajów wirusów; znaczna część dostępnych leków przeciwwirusowych jest skierowana jest przeciwko HIV-1[152]. W porównaniu z leczeniem chorób bakteryjnych, postęp w przyczynowym leczeniu chorób wirusowych jest niewielki[150].
Większość zakażeń wirusowych ulega jednak samowyleczeniu i często żadna terapia nie jest potrzebna bądź stosuje się jedynie leczenie objawowe (np. podaje lek przeciwgorączkowy)[151][153]. Jeśli jednak zakażenia wirusowe zagrażają życiu (np. przy zakażeniu HIV czy zapaleniu mózgu wywołanym przez Herpes simplex) konieczne są próby bezpośredniego zwalczania wirusów. Szczególnie trudne jest też leczenie chorób wirusowych u osób z niedoborem odporności[153].
Mechanizmy działania leków przeciwwirusowych to głównie zapobieganie adhezji, hamowanie wnikania wirusów do komórki i/lub usuwania osłonki białkowej, zakłócenie syntezy kwasu nukleinowego wirusa, hamowanie syntezy białek wirusowych czy zapobieganie uwalnianiu się wirusów[153].
Największa grupa leków przeciwwirusowych to pochodne nukleozydów, które w komórkach ulegają aktywacji do trifosforanów. Hamują aktywność wirusowej polimerazy DNA, konkurując z naturalnymi trisoforanami nukleozydów. Powinowactwo tych leków jest większe do wirusowej polimerazy niż komórkowej, ale nie zapewniają one całkowitej wybiórczości. Przykładem tego typu medykamentu jest acyklowir stosowany głównie na wirusy opryszczki typu 1 i 2[150].
W niektórych sytuacjach podawanie przeciwciał jest najskuteczniejszym sposobem leczenia. Przykładowo po pogryzieniu przez zwierzęta chore na wściekliznę, pacjenta leczy się podając surowicę z przeciwciałami przeciwko wirusowi wścieklizny (tzw. immunizacja bierna), a ponadto szczepi. Ze względu na duży koszt terapii przeciwciałami, nie są one w powszechnym użyciu, są stosowane, gdy nie ma innych leków na daną infekcję wirusową[154].
Nierzadko zdarza się, że pacjenci na infekcje wirusowe zażywają antybiotyki, które bywają przepisywane im przez lekarza. Dotyczy to m.in. przeziębień i zapalenia oskrzeli (które jest zwykle wywołane przez wirusy). Tymczasem antybiotyki są przeznaczone dla leczenia chorób bakteryjnych[155], nie mają wpływu na replikację wirusów[2]. Nieuzasadnione przyjmowanie antybiotyków przyczynia się natomiast do wykształcenia przez bakterie odporności na ich działanie[155].
Szczepionki edytuj
Szczepionki przeciwwirusowe zawierają jeden lub kilka antygenów danego typu wirusa, które po wprowadzeniu do organizmu mają na celu pobudzenie organizmu do wytworzenia swoistej odporności komórkowej i humoralnej oraz utworzenie pamięci immunologicznej. Głównym celem szczepień, ściśle rzecz biorąc, nie jest zapobieganie infekcjom wirusowym, a wyeliminowanie możliwości rozwoju choroby wirusowej u danego osobnika. Badania naukowe nie pozostawiają wątpliwości co do skuteczności szczepionek. Dzięki nim przykładowo całkowicie zwalczono wirusa ospy prawdziwej, silnie ograniczono zakażenia polio, przeprowadzono skuteczną profilaktykę odry, różyczki, żółtej febry i innych wirusowych chorób. Mimo postępu istnieje wiele wirusów, przeciw którym nadal nie udało się uzyskać szczepionki, np. wirus zapalenia wątroby typu C czy HIV[156].
Samo wykształcenie odpowiedzi immunologicznej pod wpływem podanej szczepionki wymaga kilku dni, dlatego bezcelowe jest szczepienie w momencie wystąpienia objawów choroby. Do wyjątków należy wirus wścieklizny, który potrzebuje kilku tygodni, aby dotrzeć do rdzenia kręgowego i mózgu, gdzie rozwija się choroba[157].
Epidemiologia chorób wirusowych edytuj
Niektóre wirusy wywołują z reguły niegroźne choroby takie jak przeziębienia, inne – śmiertelne jak wścieklizna. Pewne wirusy uczestniczą w rozwoju niektórych rodzajów nowotworów. Wirusologia w dużym stopniu skupia się rozwoju metod zapobiegania, diagnozowania i leczenia chorób wirusowych poprzez opracowywanie szczepionek, technik diagnostycznych i leków przeciwwirusowych[25]. Z punktu widzenia zdrowia człowieka istotne jest także poznanie wirusów zwierzęcych, które w wyniku przemian genetycznych mogą potencjalnie przystosować się także do człowieka jako gospodarza[73]. Poza tym rozwój wirusologii weterynaryjnej i roślinnej jest szczególnie istotny m.in. ze względu na straty gospodarcze wywoływane przez wirusy, na których skupiają się te dziedziny[25].
Epidemiologia wirusowych chorób człowieka i zwierzęcych edytuj
Wirusy wykazują pewne charakterystyczne cechy ważne z punktu widzenia epidemiologii, których nie spotyka się np. w chorobach bakteryjnych:
- wirusy są bezwzględnymi pasożytami wewnątrzkomórkowymi. Poza komórką przebywają tylko w fazie zakaźnej i często środowisko działa wówczas na nie zabójczo. Rozprzestrzenianie się wirusów odbywa się zwykle w wyniku dość bliskich kontaktów źródła zakażenia z potencjalnymi gospodarzami
- pewne wirusy wykazują zdolność do bardzo szybkiej, w porównaniu z mikroorganizmami, zmienności antygenowej, adaptacji do dotychczas odpornego na nie gospodarza, zmiany tropizmu (powinowactwa). Do wirusów szczególnie łatwo ulegających zmianom należą wirusy grypy, pryszczycy, wirusy Echo
- różne gatunki i typy serologiczne wirusów wywołują choroby o bardzo podobnych lub identycznych objawach. Tylko niektóre na późniejszych etapach rozwoju choroby dają objawy charakterystyczne, co sprawia, że ich rozpoznanie jest utrudnione
- pewne wirusy potrafią przetrwać w populacji gospodarzy lub przeżyć okres między epidemiami dzięki mechanizmowi latencji[158].
Największa liczba gatunków wirusów spotykana jest w populacjach o dużym zagęszczeniu wrażliwych gospodarzy. Rzadko natomiast występują choroby wirusowe wśród ludzi i zwierząt żyjących pojedynczo bądź w niewielkich grupach, które rzadko lub wcale nie mają styczności z innymi grupami[147].
Kiedy ginie zarażony wirusem gospodarz, wirus wkrótce ginie razem z nim. Kiedy zarażony gospodarz wytwarza odporność na wirusa, wirus również ginie. Jednak może też dojść do wytworzenia się równowagi immunologicznej między gospodarzem a wirusem, co określa się nosicielstwem. Im większy zakres gospodarzy może zainfekować dany wirus i im więcej może mieć pośredników (wektorów), tym większe ma szanse na przetrwanie i tym trudniejsza jest z nim walka[147].
Choroby wirusowe szerzą się różnymi drogami. Mogą przenosić się:
- na drodze kontaktów bezpośrednich, np. HIV, Hepres simplex
- drogą powietrzno-kropelkową – w taki sposób przenosi się wiele wirusów wywołujących epidemie, np. grypa, odra, ospa wietrzna
- drogą pokarmową i wodną, np. człowiek (kał) – woda – człowiek; człowiek (kał) – muchy – produkty spożywcze – człowiek. Takie wirusy wykazują pewną odporność na działanie czynników środowiska zewnętrznego. Przykładem są enterowirusy, reowirusy, rotawirusy, parwowirusy
- za pośrednictwem wektorów, zwłaszcza stawonogów, np. wirus żółtej gorączki
- drogą jatrogenną – zakażenie zachodzi w wyniku przeprowadzania zabiegów lekarskich i różnych metod leczenia, np. zastrzyki, pobieranie krwi, zabiegi chirurgiczne. Tak przenoszony jest przykładowo wirus zapalenia wątroby typu B
- w szerzeniu się niektórych wirusów pewną rolę mogą odgrywać przedmioty codziennego użytku[159].
Wirusy mogą się rozprzestrzeniać na odległe tereny za pomocą wiatru i z prądem rzek oraz w związku z migracjami – podróżami ludzi, wędrówkami ptaków, eksportem zwierząt i roślin[144].
Zakażenia wirusami mogą cechować się sezonowością. W okresie zimowym częstsze są choroby przenoszone drogą kropelkową, a latem – przenoszące się drogą pokarmową i wodną. Wyraźnej sezonowości nie obserwuje się w przypadku chorób wirusowych przenoszonych przez kontakt bezpośredni. Niektóre choroby wirusowe występują cyklicznie – co kilka, kilkanaście, kilkadziesiąt lat pojawiają się epidemie lub pandemie, np. grypy[160]. Regularne odstępy czasowe spotyka się w przypadku odry czy różyczki na terenach nieobjętych szczepieniami[161].
Na poziomie indywidualnym liczbę zakażeń można ograniczyć poprzez dbanie o higienę osobistą, a zwłaszcza mycie rąk, uprawianie seksu w sposób bezpieczny, nieużywanie wspólnych igieł do zastrzyków, izolowanie się od pacjentów z groźnymi zakażeniami i stosowanie odpowiednich szczepień w przypadku dalekich podróży. Na poziomie zbiorowym należy monitorować wodę oraz produkty żywnościowe, unikać przeludnienia, stosować powszechne programy szczepień i edukować[162].
| u człowieka | u zwierząt | ||
|---|---|---|---|
| okres | epidemia/pandemia | okres | epidemia/pandemia |
| 1918–1919 | grypa hiszpanka | 2001 | pryszczyca (Wielka Brytania) |
| 1955–1958 | grypa azjatycka | ||
| od 1981 | AIDS | ||
| 2002–2003 | SARS | od 2003 | sezonowe epidemie ptasiej grypy |
| 2009 | świńska grypa AH1N1 | ||
| od 2012 | MERS | 2006–2011 | choroba niebieskiego języka |
| 2014–2016 | gorączka krwotoczna Ebola | ||
| od 2015 | wirus Zika | od 2013 | afrykański pomór świń |
| od 2019 | COVID-19[164] | ||
Epidemiologia wirusowych chorób roślin edytuj
Największe znaczenie mają te choroby wirusowe roślin, które powodują duże i szybko narastające epidemie (lub precyzyjniej – epifitozy). Jednak tego typu zjawisk na ogół nie obserwuje się w naturze w świecie roślin, chyba że zajdą jakieś poważne zaburzenia w środowisku. Poważne epidemie chorób roślin wynikają z działalności człowieka[165].
Przyczyną tego zjawiska jest m.in. dobór roślin uprawnych – najważniejsze rośliny stanowiące źródło pokarmu dla ludzi i zwierząt to w większości rośliny jednoroczne, które w naturze nie byłyby liczącymi się konkurentami w środowiskach, gdzie rosną. W hodowli najbardziej pożądanymi cechami są plenność, jakość, jednorodność. Jeśli bierze się pod uwagę odporność, to tylko na kilka wybranych patogenów i szkodników. W efekcie na ogromnych obszarach wysiewa się jednorodne pod względem genetycznym rośliny. Takie skupiska są szczególnie podatne na choroby wirusowe[166].
Pierwotne infekcje wirusowe (tj. pierwsze na infekcje nowych roślin na danym terenie lub pierwsze infekcje w kolejnym sezonie wegetacyjnym) są dokonywane zwykle przez wirusy pochodzące z roślin wieloletnich lub z wegetatywnych części roślin przeznaczonych do rozmnażania, które przezimowały. Rzadziej odbywa się to za pośrednictwem nasion. W pewnych przypadkach wirusy mogą przetrwać w wektorach, a zupełnie wyjątkowo pierwotna infekcja zachodzi z powodu wirusów pochodzących z gleby, wody lub powietrza[167].
Epidemie chorób roślin jednorocznych, szczególnie o krótkim okresie wegetacji, przebiegają inaczej niż epidemie roślin wieloletnich. W tym pierwszym przypadku rośliny nie są dla wirusa trwałym habitatem, więc aby przetrwać, wirusy muszą mieć zdolność szybkiego rozprzestrzeniania się i opanowywania nowych terenów (np. mogą wykorzystywać jako wektory mszyce o znacznej skłonności do migracji). Takiej presji eliminującej wirusy o wolniejszym tempie rozprzestrzeniania się nie ma w przypadku roślin wieloletnich[168].
Hodowla wirusów i diagnostyka edytuj
Hodowlę wirusów prowadzi się w trzech zasadniczych celach: badawczych, diagnostycznych oraz do produkcji antygenów do szczepionek i odczynników serologicznych. Wirusy nie namnażają się poza żywymi komórkami, ograniczony jest zakres rodzajów komórek, w których dany wirus zdolny jest do namnażania, a niektórych wirusów wcale nie udaje się namnożyć w warunkach laboratoryjnych[169].
W latach 30. XX w. do namnażania wirusów zwierzęcych po raz pierwszy użyto zarodków kurzych[169]. Wraz z rozwojem podłoży dla hodowli komórek zwierzęcych i pojawieniem się antybiotyków zapobiegających zakażeniom bakteryjnym, rozwinęły się metody namnażania wirusów w hodowlach komórkowych i tkankowych[169][170].
Zarażone wirusem komórki mogą ulegać zmianom degeneracyjnym widocznym mikroskopowo lub makroskopowo, określanym jako efekt cytopatyczny[170]. Te zmiany mogą być charakterystyczne dla danego typu wirusa[171]. Zakażenie może doprowadzić do destrukcji i lizy komórki, co za pomocą odpowiednich barwników może być uwidocznione w postaci tzw. łysinek[170].
Bakteriofagi są hodowane na podłożach bulionowych lub agarowych. W tym drugim przypadku bakterie rosną w postaci tzw. murawy bakteryjnej, na której liza ich komórek pod wpływem zakażenia wirusem uwidacznia się w postaci łysinek. Wirusy roślinne są hodowane na wiele sposób – w kulturach komórkowych, tkankowych, kulturach protoplastów, a także w całych roślinach[170].
W diagnostyce wirusologicznej stosuje się trzy główne strategie:
- izolację wirusa i wykorzystanie namnażania patogenu w hodowlach komórkowych – zmiany obserwowane podczas hodowli mogą wskazywać na obecność wirusa; w metodzie shell vial hodowlę bada się przy użyciu metod serologicznych jeszcze zanim pojawi się efekt cytopatyczny
- bezpośrednie wykrycie wirusa w próbkach materiału klinicznego – wykorzystuje się w tym celu identyfikację wirusa za pomocą mikroskopu elektronowego, antygenów wirusowych z użyciem metod serologicznych lub genomu wirusa przy zastosowaniu metod biologii molekularnej (np. PCR)
- wykrywanie przeciwciał w surowicy pacjenta, które pojawiają się w wyniku stymulacji odporności humoralnej przez zakażenie wirusowe. Z tą metodą wiąże się problem oceny, czy ewentualny pozytywny wynik wskazuje na ostre, bieżące zakażenie, czy na kontakt z wirusem w przeszłości[172].
Unieczynnienie wirusów edytuj
Istnieją pewne sytuacje, kiedy występuje potrzeba zachowania zakaźności wirusa, np. podczas transportu i przechowywania próbek krwi bądź śliny pacjentów przed badaniami diagnostycznymi, czy w ogóle w pracy wirusologów z wirusami. W wielu jednak sytuacjach zachodzi konieczność inaktywacji wirusa, doprowadzenia do utraty jego zakaźności. Przykładowo w placówkach służby zdrowia w tym celu dezynfekuje się powierzchnie i sterylizuje sprzęt medyczny. Inaktywowane szczepionki wirusowe wytworzone są na bazie zjadliwych wirusów całkowicie pozbawionych zakaźności. Stosuje się zabiegi, by zniszczyć wirusy w wodzie pitnej, basenowej czy preparatach krwiopochodnych. W pracy wirusologów wymagane są materiały (takie jak pipety, naczynia hodowlane) całkowicie wolne od wirusów, a po ich użyciu wszelkie pozostałe na nich wirusy muszą zostać inaktywowane przed wyrzuceniem[173].
W procesach biotechnologicznych wykorzystujących bakterie bakteriofagi mogą doprowadzić do pogorszenia jakości, spowolnienia lub niepowodzenia produkcji[173]. Problemy wynikające z obecności fagów odnotowano w przemyśle spożywczym, chemicznym, farmaceutycznym, paszowym i przy produkcji pestycydów. Najlepiej są one udokumentowane w przemyśle mleczarskim, gdzie fagi stanowią główną przyczynę nieudanych fermentacji. Choć stężenie bakteriofagów w mleku jest niskie, szybko rośnie, jeśli w kulturach starterowych znajdują się komórki wrażliwe na infekcję nimi. Wypracowano więc procedury ograniczające to ryzyko. Wiąże się to z odpowiednim projektowaniem zakładów produkcyjnych, wyższą higieną procesów, używaniem specjalnego podłoża hodowlanego, stosowaniem rotacji szczepów, wykorzystywaniem szczepów odpornych na infekcje fagowe[174]. Powszechnym zabiegiem jest termiczna inaktywacja mikroorganizmów, pasteryzacja[175].
Wszystkie wirusy z czasem ulegają unieczynnieniu. Tempo utraty zakaźności w dużym stopniu zależy od temperatury. Istnieje duża różnorodność wśród wirusów względem tej właściwości. Wirusy bezotoczkowe są generalnie bardziej termostabilne niż otoczkowe. Większość wirusów ulega całkowitej dezaktywacji w ciągu 30 minut w temperaturze 60 °C oraz w ciągu kilku sekund w temperaturze 100 °C. Niektóre wiriony wirusów są szczególnie odporne na działanie wysokich temperatur. Dotyczy to przykładowo parwowirusów. Szczególną odporność termiczną mają też wirusy infekujące termofilne prokarioty[176].
W temperaturach poniżej –35 °C większość wirusów ulega z czasem bardzo spowolnionej utracie zakaźności, dlatego w przypadku konieczności długotrwałego przechowywania wirusów odbywa się to w takich właśnie warunkach, np. w ciekłym azocie[176]. O dużej skuteczności niskich temperatur w zachowywaniu zakaźności wirusa mimo upływu czasu dowodzi fakt, że wykazywały ją nadal wirusy sprzed 30 000 lat wyizolowane z syberyjskiej wiecznej zmarzliny[177].
Poza wysoką temperaturą, czynnikami, które mogą inaktywować („zabijać”) wirusy są formy promieniowania, które uszkadzają materiał genetyczny (promieniowanie X, promieniowanie gamma, promieniowanie ultrafioletowe) oraz pewne związki chemiczne takie jak kwas podchlorawy i jego zdysocjowana forma – jon podchlorynowy, aldehydy (formaldehyd, aldehyd glutarowy), alkohole (etanol, izopropanol), detergenty i wiele rozpuszczalników organicznych (np. chloroform), które usuwają lipidową otoczkę oraz związane z nią glikoproteiny[178].
Zakaźność wirionu może być także zniesiona poprzez zmianę lub usunięcie jego kwasu nukleinowego i/lub jednego bądź kilku białek. Modyfikacja białek może polegać na wprowadzeniu zmiany konformacyjnej czy zerwaniu wiązań kowalencyjnych[176].
Tempo, w którym wirusy tracą swoją zakaźność w danych warunkach (np. w określonej temperaturze czy określonym pH) nie zawsze jest stałe. Bywa, że po utracie znakomitej większości swojej zakaźności (zwykle ponad 99%) tempo dalszej jej utraty staje się wolniejsze. Nie do końca wiadomo, dlaczego tak się dzieje. Przypuszcza się, że pewna część wirionów może mieć zwiększoną odporność na dany inaktywujący czynnik i/lub próbka może zawierać skupiska wirionów, a w związku z tym czynnik może mieć utrudniony dostęp do tych cząstek znajdujących się w ich centrum[176].
Pochodzenie wirusów i ewolucja edytuj
Pochodzenie wirusów jest niepewne, co częściowo spowodowane jest niepozostawianiem przez nie materiału kopalnego[179]. Ponieważ wirusy jako pasożytnicze elementy genetyczne otoczone białkowym kapsydem nie replikują się poza komórką, bardzo prawdopodobne jest, że mają wspólne pochodzenie z komórkami[180]. Można wyodrębnić trzy klasy genów wirusowych:
- geny mające swoje homologi komórkowe;
- geny występujące wyłącznie u wirusów (ang. ORFans);
- kluczowe geny wirusowe (ang. hallmark genes) o odległych homologach komórkowych[180].
Istnieją trzy główne teorie wyjaśniające pochodzenie wirusów, z jednej strony podparte licznymi dowodami, z drugiej zawierające pewne luki[180]:
- teoria koewolucji – wirusy występowały przed pierwszymi komórkami, pojawiły się w środowisku „prebiotycznej zupy” jako cząsteczki RNA zdolne do samodzielnej replikacji. Na późniejszym etapie stały się pasożytami komórkowymi zależnymi od ich enzymów i innych substancji, podlegając koewolucji[180]
- teoria ucieczki – wirusy powstały z fragmentów RNA bądź DNA takich jak transpozony czy plazmidy, które uwolniły się z komórki. Później w wyniku zmian genetycznych zyskały sekwencje nukleotydów kodujące białka kapsydu[180]. Zatem teoria ta zakłada, że wirusy pojawiły się później niż komórki[181]
- teoria regresyjna – wirusy powstały z pierwotnych komórek, które utraciły część swojego materiału genetycznego, zachowując jednak geny pozwalające na replikację swojego genomu[180]. Być może były to małe komórki prokariotyczne pasożytujące na komórkach większych[179].
Wirusy są ważną siłą napędową ewolucji[182], stanowią ogromny rezerwuar różnorodności genetycznej[183], a wirusowe zakażenie ma potencjał, by wprowadzać nową genetyczną informację do danego organizmu żywego lub do potomnych wirusów[182]. Geny pochodzenia komórkowego wirusy mogą pozyskać przez mechanizm rekombinacji. Może się ona odbyć pomiędzy genomem wirusowym a genomem komórkowym, jeśli znajdą się one blisko siebie (np. gdy wirusowy materiał genetyczny wchodzi do jądra komórkowego i tam się replikuje). Drugim możliwym mechanizmem jest rekombinacja między genomem wirusowym a komórkowym mRNA, który uprzednio został przepisany na cDNA. W tym wypadku niezbędny jest udział odwrotnej transkryptazy[184].
W laboratoryjnych hodowlach wirusów w komórkach odkryto, że pomimo oszczędnego wykorzystywania genomu do kodowania informacji, niektóre geny wirusowe nie są im niezbędne do przetrwania. Mogą być one utracone przy kolejnych pasażowaniach i takie zmutowane wirusy wypierają rodzicielskie szczepy dzikie. W naturze jednak geny te utrzymywane są przez miliony lat, ponieważ najprawdopodobniej dają one przewagę w bardziej wymagających, naturalnych warunkach[70].
Rys historyczny edytuj
Choroby wirusowe jak wścieklizna, odra czy ospa były znane od starożytności, ale nie zdawano sobie sprawy, co je wywołuje[186]. Przykładowo na podstawie charakterystycznej wysypki na zmumifikowanym ciele Ramzesa V wiadomo, że zmarł on z powodu ospy prawdziwej[187].
Wirusy miały niemały wpływ na ludzkość – były np. przyczyną wielkiej epidemii w imperium rzymskim w latach 165–180 i znacząco osłabiły państwo. Podbój imperium Azteków w mieście Meksyk przez Europejczyków został znacznie ułatwiony przez wybuch epidemii ospy prawdziwej, która dziesiątkowała lokalną ludność. Najprawdopodobniej została zawleczona w 1520 przez ekspedycję wysłaną dla wsparcia Cortésa[186].
Na początku XVIII w. arystokratka Mary Wortley Montagu, żona angielskiego ambasadora w Turcji, zauważyła, że tamtejsze kobiety stosowały na swoich dzieciach tzw. wariolizację – zarażały je ospą prawdziwą poprzez wydzieliny ropne od pacjentów o łagodnym przebiegu choroby. U dzieci tych również rozwijała się łagodna postać, a następnie stawały się na ospę odporne[186]. Metoda ta znana była już wcześniej w Chinach[188]. Montagu próbowała ją rozpowszechnić w Anglii, ale bez większego powodzenia[186].
Wariolizacja, choć była metodą skuteczną, była również niebezpieczna, ponieważ nie zawsze można było przewidzieć, jak dany organizm na nią zareaguje. Edward Jenner w wieku 7 lat niemal stracił przez nią życie, co spowodowało, że później chciał znaleźć alternatywną metodę zapobiegania chorobie[188]. Zainspirowany obserwacją, że mleczarki zakażone krowianką są odporne na ospę prawdziwą, zaczął przeszczepiać materiał pobrany z wysypki zdrowym ludziom. W 1798 opublikował wyniki 23 udanych szczepień. Mimo to nie rozumiał mechanizmów tego zjawiska[186].
Dopiero w latach 80. XIX w. Robert Koch i Louis Pasteur wysunęli „teorię zarazków”, zakładającą, że choroby wywołują drobnoustroje. Koch sformułował także kryteria (tzw. postulaty Kocha) pozwalające sprawdzić związek między mikroorganizmami a daną chorobą[188]. Pasteur używał terminu wirus (z łac. jad[e]) dla wszystkich biologicznych czynników chorobotwórczych, nazywał tak także bakterie[186][188].
W 1884 Charles Chamberland stworzył filtr o porach mniejszych niż wielkość bakterii[186]. W 1892 Dmitrij Iwanowski przesączył przez taki filtr ekstrakt z liści roślin zakażonych wirusem mozaiki tytoniu. Filtr ten zatrzymywał najmniejsze znane wówczas bakterie, ale nie był w stanie zatrzymać czynnika chorobotwórczego odpowiedzialnego za mozaikowatość tytoniu. Iwanowski nie zdawał sobie jednak sprawy z pełnego znaczenia swego odkrycia. W 1898 Martinus Beijerinck potwierdził i rozwinął te badania[191]. Doszedł do wniosku, że musi mieć w tym przypadku do czynienia z nową formą czynnika chorobotwórczego. Nazwał go contagium vivum fluidum (żywy płynny zarazek) i miał na myśli to, co współcześnie rozumie się pod pojęciem wirusa[192]. Jeszcze w tym samym roku Friedrich Loeffler i Paul Frosch wykazali, że podobny czynnik jest odpowiedzialny za pryszczycę u bydła, a w 1909 Karl Landsteiner i Erwin Popper odkryli, że inny tego typu czynnik jest odpowiedzialny za ludzką chorobę Heinego-Medina[191]. Taką grupę czynników chorobotwórczych nazywano wirusami przesączalnymi lub po prostu wirusami[193].
Frederick Twort w 1915 i Felix d’Herelle w 1917 niezależnie odkryli, że wirusy mogą infekować również bakterie. d’Herelle nazwał je bakteriofagami (dosłownie zjadaczami bakterii)[191]. Pandemia grypy hiszpanki, która wybuchła w czasach, gdy I wojna światowa zmierzała ku końcowi, pochłonęła znacznie więcej ofiar niż sama wojna[194]. Szacuje się, że grypą tą zaraziła się jedna trzecia ówczesnej ludności świata[195].
Fizyczna natura wirusów została poznana w latach 30. XX w. wraz z opracowaniem mikroskopu elektronowego, jako że niemal wszystkie wirusy są zbyt małe, by można było je ujrzeć w mikroskopie świetlnym[196]. W 1935 Wendell Meredith Stanley skrystalizował wirusa mozaiki tytoniu (TMV) i stwierdził, że jest on w dużej mierze lub całkowicie zbudowany z białka. Niedługo później Frederick Bawden i Norman Pirie stwierdzili, że TMV składa się z białka i kwasu nukleinowego. Stało się też jasne, że wirusy mogą się reprodukować tylko w żywych komórkach[186]. Dalsze badania dawały informacje o budowie wirusów, ich genetyce i sposobie replikacji, m.in. dzięki publikacjom takich wirusologów jak Salvador Luria czy Max Delbrück[191].
Dostępność hodowli komórkowych pozwoliła na odkrycie wielu nowych wirusów. W 1949 Johnowi Endersowi z zespołem skutecznie udało się namnożyć wirusa polio w takich kulturach, co wkrótce doprowadziło do opracowania szczepionki[197].
Definicja wirusa Andrégo Lwoffa z 1957 zwykle uważana jest za pierwszy wyczerpujący ich opis. Zgodnie z jej oryginalną wersją wirus to zakaźna, potencjalnie patogenna nukleoproteina zawierająca tylko jeden typ kwasu nukleinowego, reprodukująca się za pomocą swojego materiału genetycznego, niezdolna do bezpośredniego wzrostu i podziałów, pozbawiona systemu Lipmanna (tj. enzymów i innych związków chemicznych związanych z dostarczaniem energii)[1][198].
W 1970 Howard Temin i David Baltimore odkryli odwrotną transkryptazę umożliwiającą przepisanie RNA na DNA. W 1979 ogłoszono, że ospa prawdziwa, choroba wirusowa, została całkowicie zwalczona (eradykowana). Rozwój technik biologii molekularnej od połowy lat 70. XX w. do końca XX w. zrewolucjonizował wirusologię, m.in. technologia rekombinowanego DNA oraz PCR[199]. W 1983–1984 odkryto, że choroba AIDS jest wywoływana przez wirusa. Wirus ten, HIV, stał się najbardziej intensywnie badanym czynnikiem zakaźnym. Badania te przyczyniły się m.in. do rozwoju takich dziedzin jak immunologia czy biologia komórki[200]. W 2001 w związku z poznaniem ludzkiego genomu okazało się, że zawiera on retrowirusowe sekwencje[201].
Znaczenie wirusów edytuj
Wirusy występują właściwie wszędzie, wszystkie organizmy stykają się na co dzień z ogromną liczbą cząstek wirusowych. Wirusy znajdują się przykładowo na i w ciele człowieka, i są to zarówno takie, które potencjalnie mogą go zainfekować, jak i takie, które zupełnie takich możliwości nie mają. Zdecydowana większość wirusów nie ma praktycznie żadnego wpływu na zdrowie i samopoczucie. Niektóre jednak, zdolne do zainfekowania danego organizmu, mogą zdołać „przechytrzyć” jego układ odpornościowy (zwłaszcza gdy jest osłabiony) i wywołać różne choroby, od bardzo łagodnych po śmiertelne. Pewne wirusy mogą wywołać epidemię[202] oraz powodować różnego rodzaju straty gospodarcze[25]. Zdarza się, że zainfekowanie jednym wirusem ma łagodzący wpływ na postęp choroby wywoływanej przez innego wirusa (lub bakterię), np. zakażenie wirusem GB-C na AIDS[202]. Zakażenia pewnymi wirusami mogą powodować zmiany zachowania, np. agresja i wodowstręt w przypadku wścieklizny[203].
Wirusy wpływają na cykle biogeochemiczne. W tym aspekcie najlepiej zbadana jest ich rola w środowiskach morskich, gdzie mniej więcej na taką samą skalę jak protisty zabijają mikroorganizmy takie jak bakterie i archeony. W ten sposób powodują uwolnienie z komórek substancji (liza), które mogą stanowić pożywienie dla kolejnych mikrooorganizmów. Przez atakowanie autotrofów mogą wpływać na produkcję pierwotną[204], a także na zakwity wód[205]. Są więc bardzo ważnym elementem w obiegu węgla w oceanach[204].
Wirusy napędzają ewolucję mikroorganizmów poprzez mechanizmy naturalnej selekcji mikrobów odpornych na infekcję oraz poziomy transfer genów; przenoszą zresztą materiał genetyczny nie tylko między organizmami, ale także, w szerszym wymiarze, między ekosystemami. Pewne wirusy są zdolne infekować tylko określony szczep danego mikroorganizmu. Kiedy taki szczep zacznie dominować w środowisku, zwiększy się także liczba wirusów atakujących go, tworząc niszę dla innego szczepu. Pewne geny przenoszone przez wirusy mają szczególnie istotne znaczenie. Przykładowo większość szczepów przecinkowca cholery (bakterii) nie jest patogeniczna dla ludzi[204]. Staje się taka dopiero w wyniku integracji materiału genetycznego bakteriofaga CTX (wirusa zawierającego gen kodujący toksynę cholery) z genomem bakterii[206][204]. Dla bakterii takie zakażenie wirusem jest korzystne – może dzięki temu wywoływać u ludzi biegunki potencjalnie zanieszyczające wodę, sprzyjające dalszemu rozprzestrzenianiu bakterii[206]. Mechanizmy te nie dotyczą jednak tylko mikroorganizmów. Polidnawirusy, mając materiał genetyczny integrowany z owadzim genomem, namnażają się w jajnikach pasożytniczych os, a ich wiriony są wstrzykiwane razem z jajami os do ciała gąsienicy gospodarza. Wiriony te zawierają geny os, które powodują tłumienie odpowiedzi układu immunologicznego gąsienicy, umożliwiając jajom przetrwanie i rozwój. Wirusy i osy pasożytnicze tworzą więc układy symbiotyczne[203][207]. Co więcej, pewne białka biorące udział w tworzeniu łożyska u ssaków są kodowane przez sekwencje pochodzące od retrowirusów (ERV), których genom przed milionami lat uległ integracji z genomem gospodarza[208][209] (a dokładniej z genomem jego komórki jajowej lub plemnika)[209].
Według naukowców duże znaczenie wirusów w przyrodzie, zarówno w skali pojedynczej komórki, jak i całych ekosystemów, pozwala twierdzić, że życie na Ziemi bez wirusów byłoby zupełnie inne, o ile w ogóle możliwe[203].
Wykorzystanie wirusów edytuj
Różnorodność genów i sekwencji regulatorowych w genomach wirusów dostarcza wielu użytecznych elementów stosowanych w inżynierii genetycznej, biologii molekularnej i biotechnologii[210]. Wirusy odgrywają znaczącą rolę w rozwoju tych nauk – wykorzystywane są jako systemy modelowe dla różnych procesów biologicznych, dostarczają narzędzi dla zrozumienia mechanizmów replikacji DNA, rekombinacji, transkrypcji, translacji, regulacji genów i innych[211]. Wykorzystuje się wiele enzymów pochodzenia wirusowego, choć większość z nich jest produkowana w modyfikowanych genetycznie bakteriach. Wirusy stosuje się także do konstruowania wektorów genetycznych. Mogą być potem używane do klonowania DNA (np. do tworzenia bibliotek genowych), wytwarzania białka (wektory ekspresyjne), prezentacji fagowej (technika szukania sekwencji oddziałujących z danym ligandem, np. białkiem), jako narzędzie w terapii genowej czy jako szczepionki. Bakteriofagi, dzięki swojej swoistości, są świetnym narzędziem do wykrywania i identyfikacji bakterii[212]. Przykładowo szczepy bakterii Salmonella rozróżniać można na podstawie spektrum fagów, które są zdolne do ich zakażania[210].
Wirusy próbuje się wykorzystywać jako czynniki terapeutyczne w wirusoterapii do stosowania w leczeniu infekcji bakteryjnych (fagoterapia) oraz w walce z chorobami nowotworowymi (wirusy onkolityczne)[213]. Wirusów używano już w latach 50. XX w. do leczenia pewnych ludzkich chorób bakteryjnych, ale zostały wyparte przez antybiotyki. Wzbudzają one jednak ponowne zainteresowanie w obliczu uzyskiwania przez bakterie oporności na antybiotyki[210].
Bakulowirusy pozwalają ograniczać liczebność owadzich szkodników roślin[210]. Ślady dawnych zakażeń pewnymi wirusami pozwalają na śledzenie migracji ludzi sprzed wielu wieków[214]. Potencjalnie wirusy mogą też być wykorzystane jako broń biologiczna[215].
Zobacz też edytuj
Uwagi edytuj
- ↑ Arenawirusy zawierają komórkowe rybosomy, ale pochodzą one od komórki będącej gospodarzem – są pakowane do wirionu podczas składania cząstki wirusa[1]
- ↑ Termin wirion oznacza kompletną cząstkę wirusową, która znajduje się w pozakomórkowej fazie cyklu replikacyjnego[3]. Określenie wirion bywa używane także jako synonim wirusa[4], ale jest to błąd porównywalny z myleniem terminu owad (zawierającym w sobie wszystkie stadium rozwojowe owadów) z którymś z tych stadium, np. poczwarką[5]
- ↑ Jednoniciowy RNA funkcjonujący jako wirusowy genom można podzielić na taki o dodatniej polarności i taki o ujemnej polarności. RNA genomowe o dodatniej polarności może być użyte bezpośrednio w roli mRNA, natomiast u genomowe RNA o ujemnej polarności musi najpierw ulec transkrypcji[9][44]
- ↑ Wyjątkiem pod tym względem jest rybi wirus – Walleye dermal sarcoma virus (WDSV)[135]
- ↑ Łaciński wyraz vīrus oznacza jad, substancję niepoliczalną i w klasycznej łacinie nie tworzył liczby mnogiej[189]. Co więcej, jego użycie ograniczało się w dużej mierze do formy mianownika i biernika liczby pojedynczej[190] (rzeczownik defektywny). Pryscjan (VI w. n.e.) pisał nawet, że niektórzy uznają ten rzeczownik za nieodmienny. Nowe znaczenie – cząstka zakaźna – zyskał w czasach nowożytnych. Brytyjczyk William Thomas Stearn w swoim opracowaniu dotyczącym łaciny w botanice zaproponował, że ze słowa vīrus w tym nowym znaczeniu można utworzyć liczbę mnogą – vīra, typową dla rzeczowników drugiej deklinacji rodzaju nijakiego[189].
Przypisy edytuj
- ↑ a b c d e f Józefiak 2019 ↓, s. 1.
- ↑ a b Bienz 2007 ↓, s. 347.
- ↑ Prescott 2002 ↓, s. G–28.
- ↑ Kańtoch 1998 ↓, s. 24.
- ↑ a b Marc H.V. Van Regenmortel, Virus Species, [w:] Michel Tibayrenc (red.), Genetics and Evolution of Infectious Diseases, Elsevier, 2011, s. 7, 10, ISBN 978-0-12-384890-1.
- ↑ a b Bienz 2007 ↓, s. 348.
- ↑ a b Payne 2017 ↓, s. 13.
- ↑ Collier i Oxford 2006 ↓, s. 8.
- ↑ a b c d Collier i Oxford 2006 ↓, s. 10.
- ↑ a b Collier i Oxford 2001 ↓, s. 21.
- ↑ a b c VanMeter i Hubert 2016 ↓, s. 105.
- ↑ Józefiak 2019 ↓, s. 4.
- ↑ a b VanMeter i Hubert 2016 ↓, s. 108.
- ↑ a b Bienz 2007 ↓, s. 349.
- ↑ Józefiak 2019 ↓, s. 5.
- ↑ a b Józefiak 2019 ↓, s. 3.
- ↑ Mauricio G. Mateu, Assembly, Englineering and Applications of Virus-Based Protein Nanoparticles, [w:] Aitziber L. Cortajarena, Tijana Z. Grove (red.), Protein-based Engineered Nanostructures, Springer, 2016, s. 87, DOI: 10.1007/978-3-319-39196-0, ISBN 978-3-319-39194-6.
- ↑ Prescott 2002 ↓, s. 369.
- ↑ Prescott 2002 ↓, s. 376.
- ↑ Payne 2017 ↓, s. 13, 20.
- ↑ Patrick R. Murray, Ken S. Rosenthal, Michael A. Pfaller, Medical Microbiology, Elsevier, 2016, s. 358, ISBN 978-0-323-29956-5.
- ↑ a b Cann 2005 ↓, s. 2–3.
- ↑ Ed Yong: Giant virus resurrected from 30,000-year-old ice. [w:] Nature: News [on-line]. 2014-03-04. [dostęp 2014-03-04]. (ang.).
- ↑ Matthieu Legendre i inni, Thirty-thousand-year-old distant relative of giant icosahedral DNA viruses with a pandoravirus morphology, „Proceedings of the National Academy of Sciences of the United States of America”, 111 (11), Stanford University’s HighWire Press, 2014, s. 4274–9, DOI: 10.1073/pnas.1320670111, ISSN 1091-6490, PMID: 24591590, PMCID: PMC3964051 (ang.).
- ↑ a b c d e f g Carter i Saunders 2007 ↓, s. 3.
- ↑ a b c Józefiak 2019 ↓, s. 297–298.
- ↑ a b Dorothy H. Crawford, Viruses: A Very Short Introduction, Oxford University Press, 2011, s. 16, ISBN 978-0-19-957485-8.
- ↑ Carter i Saunders 2007 ↓, s. 5.
- ↑ Payne 2017 ↓, s. 82.
- ↑ a b Louten 2016 ↓, s. 54.
- ↑ a b c Carter i Saunders 2007 ↓, s. 32.
- ↑ a b c d e Kenneth J. Ryan (red.), Medical Microbiology, wyd. VII, McGraw Hill Education, 2018, s. 100, 127, ISBN 978-1-25-985981-6.
- ↑ a b Stefan Riedel i inni, Jawetz, Melnick & Adelberg’s Medical Microbiology, McGraw Hill, 2019, s. 422, ISBN 978-1-26-001203-3.
- ↑ Roger L. Lundblad, Biochemistry and Molecular Biology Compendium, CRC Press. Taylor & Francis Group, 2020, s. 38, ISBN 978-1-138-05458-5.
- ↑ J M Coffin, S H Hughes, H E Varmus, Reverse Transcription of the Viral Genome in vivo, [w:] Retroviruses [online], 1997 [dostęp 2020-08-26].
- ↑ a b Carter i Saunders 2007 ↓, s. 5–6.
- ↑ Kryczyński 2010 ↓, s. 38.
- ↑ a b c Carter i Saunders 2007 ↓, s. 32–33.
- ↑ Lubert Stryer, Jeremy M. Berg, John L. Tymoczko, Biochemia, Warszawa: Wydawnictwo Naukowe PWN, 2009, s. 116, ISBN 978-83-01-15811-8.
- ↑ Carter i Saunders 2007 ↓, s. 91.
- ↑ a b c VanMeter i Hubert 2016 ↓, s. 105–106.
- ↑ a b c Carter i Saunders 2007 ↓, s. 116–117.
- ↑ David O. White, Frank J. Fenner, Medical Virology, wyd. IV, Academic Press, 1994, s. 17, ISBN 0-12-746642-8.
- ↑ Teri Shors, Understanding viruses, Jones & Bartlett, 2017, ISBN 978-1-284-05789-8.
- ↑ Collier i Oxford 2001 ↓, s. 27.
- ↑ a b International Committee on Taxonomy of Viruses, Virus Taxonomy: 2019 Release [online], ICTV, 2019 [dostęp 2020-08-26].
- ↑ International Committee on Taxonomy of Viruses, The International Code of Virus Classification and Nomenclature [online], ICTV, 2018 [dostęp 2020-08-26].
- ↑ a b c Józefiak 2019 ↓, s. 11–17.
- ↑ Irving, Boswell i Aldeen 2008 ↓, s. 23–25.
- ↑ a b Bienz 2007 ↓, s. 357.
- ↑ a b Józefiak 2019 ↓, s. 16–17.
- ↑ Cann 2005 ↓, s. 91.
- ↑ Gustavo Fermin, Virion Structure, Genome Organization, and Taxonomy of Viruses, [w:] Paula Tennant, Gustavo Fermin, Jerome E. Foster (red.), Viruses. Molecular Biology, Host Interactions and Applications to Biotechnology, Academic Press, 2018, s. 46, DOI: 10.1016/B978-0-12-811257-1.00002-4, ISBN 978-0-12-811257-1.
- ↑ a b c d e f g h i j k l m n o p q Józefiak 2019 ↓, s. 31–116.
- ↑ a b c d e f g h i Bienz 2007 ↓, s. 380–438.
- ↑ Collier i Oxford 2001 ↓, s. 135.
- ↑ Fei Zhou i inni, Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study, „The Lancet”, 2020, DOI: 10.1016/S0140-6736(20)30566-3.
- ↑ Eugene V. Koonin, Petro Starokadomskyy, Are viruses alive? The replicator paradigm sheds decisive light on an old but misguided question, „Studies In History and Philosophy of Biological and Biomedical Sciences” (59), 2016, s. 125–134, DOI: 10.1016/j.shpsc.2016.02.016.
- ↑ a b c Hull 2009 ↓, s. 13.
- ↑ L.P. Villarreal, Evolution of Viruses, „Elsevier Public Health Emergency Collection”, 2008, s. 174–184, DOI: 10.1016/B978-012374410-4.00706-8.
- ↑ Ed Rybicki, The classification of organisms at the edge of life, or problems with virus systematics, „South African Journal of Science”, 86, 1990, s. 182–186.
- ↑ Cann 2005 ↓, s. 1.
- ↑ a b Flint 2015a ↓, s. 21.
- ↑ Ed Yong, Giant viruses open Pandora’s box, Nature, 2013, DOI: 10.1038/nature.2013.13410 [dostęp 2021-01-15].
- ↑ a b Agnieszka Szuster-Ciesielska, Zagrożenia zakażeniami wirusowymi, „Zakażenia” (2), 2013, s. 18–25.
- ↑ a b c d John Oxford, Paul Kellam, Leslie Collier, Human Virology, Oxford University Press, 2016, s. 30, ISBN 978-0-19-107381-6.
- ↑ Everett Clinton Smith, The not-so-infinite malleability of RNA viruses: Viral and cellular determinants of RNA virus mutation rates, „PloS Pathogens”, 13 (4), 2017, s. 1–6, DOI: 10.1371/journal.ppat.1006254.
- ↑ a b J.N. Barr, R. Fearns, Genetic Instability of RNA Viruses, „Genome Stability”, 2016, s. 21–35, DOI: 10.1016/B978-0-12-803309-8.00002-1.
- ↑ a b Jozef J Bujarski, Recombination of viruses, „Encyclopedia of Virology”, 1999, s. 1446–1453, DOI: 10.1006/rwvi.1999.0334.
- ↑ a b c Payne 2017 ↓, s. 84.
- ↑ a b Etienne Simon-Loriere, Edward C. Holmes, Why do RNA viruses recombine?, „Nature Reviews. Microbiology”, 9 (8), 2011, s. 617–626, DOI: 10.1038/nrmicro2614.
- ↑ a b Józefiak 2019 ↓, s. 13.
- ↑ a b Jabłoński 2002 ↓, s. 284–285.
- ↑ Kendall P. Myers, Christopher W. Olsen, Gregory C. Gray, Cases of Swine Influenza in Humans: A Review of the Literature, „Clinical Infectious Diseases”, 44 (8), 2007, s. 1084–1088, DOI: 10.1086/512813.
- ↑ a b c Payne 2017 ↓, s. 56–58.
- ↑ Pommerville 2018 ↓, s. 501.
- ↑ a b Dimmock 2007 ↓, s. 215–217.
- ↑ Carter i Saunders 2007 ↓, s. 269–270.
- ↑ Carter i Saunders 2007 ↓, s. 274.
- ↑ a b Pommerville 2018 ↓, s. 524.
- ↑ Carter i Saunders 2007 ↓, s. 276.
- ↑ a b c Carter i Saunders 2007 ↓, s. 6.
- ↑ a b Józefiak 2019 ↓, s. 18.
- ↑ Cann 2005 ↓, s. 2.
- ↑ Collier i Oxford 2001 ↓, s. 19.
- ↑ a b Bienz 2007 ↓, s. 351.
- ↑ Carter i Saunders 2007 ↓, s. XV–XVI.
- ↑ a b Zaremba i Borowski 2001 ↓, s. 483.
- ↑ a b Józefiak 2019 ↓, s. 25.
- ↑ a b c Flint 2015a ↓, s. 31.
- ↑ a b Flint 2015b ↓, s. 36.
- ↑ a b c d e Clare L. Jolly, Quentin J. Sattentau, Attachment Factors, [w:] Stefan Pöhlmann, Graham Simmons (red.), Viral Entry into Host Cells, Springer, 2006, s. 1–3, DOI: 10.1007/978-1-4614-7651-1_1, ISBN 978-1-4614-7651-1.
- ↑ a b c d e Józefiak 2019 ↓, s. 19.
- ↑ a b Bienz 2007 ↓, s. 354.
- ↑ a b Józefiak 2019 ↓, s. 21.
- ↑ a b Carter i Saunders 2007 ↓, s. 68.
- ↑ a b c Józefiak 2019 ↓, s. 21–22.
- ↑ Dimmock 2007 ↓, s. 71.
- ↑ a b VanMeter i Hubert 2016 ↓, s. 115–116.
- ↑ Zaremba i Borowski 2001 ↓, s. 547.
- ↑ Józefiak 2019 ↓, s. 24.
- ↑ Dimmock 2007 ↓, s. 26.
- ↑ Józefiak 2019 ↓, s. 2.
- ↑ Carter i Saunders 2007 ↓, s. 97.
- ↑ Carter i Saunders 2007 ↓, s. 97–98.
- ↑ a b c Carter i Saunders 2007 ↓, s. 100–101.
- ↑ Flint 2015a ↓, s. 17.
- ↑ Carter i Saunders 2007 ↓, s. 51.
- ↑ a b Józefiak 2019 ↓, s. 171–172.
- ↑ Kryczyński 2010 ↓, s. 61–66.
- ↑ Kryczyński 2010 ↓, s. 70–71.
- ↑ Kryczyński 2010 ↓, s. 74–75.
- ↑ a b c d e Józefiak 2019 ↓, s. 197–201.
- ↑ VanMeter i Hubert 2016 ↓, s. 109.
- ↑ a b Carter i Saunders 2007 ↓, s. 230.
- ↑ Marie-Ève Dupuis i inni, CRISPR-Cas and restriction–modification systems are compatible and increase phage resistance, „Nature Communications”, 4, 2013, DOI: 10.1038/ncomms3087.
- ↑ Józefiak 2019 ↓, s. 117.
- ↑ Józefiak 2019 ↓, s. 194–195.
- ↑ a b c d e Józefiak 2019 ↓, s. 184–186.
- ↑ a b c d e Kunj B. Pathak, Peter D. Nagy, Defective Interfering RNAs: Foes of Viruses and Friends of Virologists, „Viruses”, 1 (3), 2009, DOI: 10.3390/v1030895.
- ↑ Józefiak 2019 ↓, s. 182.
- ↑ Christelle Desnues, Didier Raoult, Virophages question the existence of satellites, „Nature Reviews Microbiology”, 10 (234), 2012, DOI: 10.1038/nrmicro2676-c3.
- ↑ Olga Orzyłowska-Śliwińska. Wiadomo, że wirusy atakują bakterie, ale czy mogą atakować inne wirusy?. „Świat Nauki”. 6 (238), s. 83, czerwiec 2011. Prószyński Media. ISSN 0867-6380.
- ↑ Dimmock 2007 ↓, s. 214–215.
- ↑ a b c d e f Bienz 2007 ↓, s. 361–365.
- ↑ Dimmock 2007 ↓, s. 215–216.
- ↑ a b c Pommerville 2018 ↓, s. 514–515.
- ↑ a b Carter i Saunders 2007 ↓, s. 111.
- ↑ a b c d Dimmock 2007 ↓, s. 219–221.
- ↑ Dimmock 2007 ↓, s. 221–222.
- ↑ Dimmock 2007 ↓, s. 341.
- ↑ Dimmock 2007 ↓, s. 344.
- ↑ a b Dimmock 2007 ↓, s. 219–222.
- ↑ Flint 2015b ↓, s. 175.
- ↑ Flint 2015b ↓, s. 184.
- ↑ Józefiak 2019 ↓, s. 155–156.
- ↑ Dimmock 2007 ↓, s. 222–223.
- ↑ Zaremba i Borowski 2001 ↓, s. 500.
- ↑ a b Kańtoch 1998 ↓, s. 101–102.
- ↑ a b Kańtoch 1998 ↓, s. 104–107.
- ↑ a b c d Bienz 2007 ↓, s. 365–366.
- ↑ a b c Józefiak 2019 ↓, s. 26.
- ↑ Kańtoch 1998 ↓, s. 99.
- ↑ a b Józefiak 2019 ↓, s. 26–27.
- ↑ a b c d Józefiak 2019 ↓, s. 209–211.
- ↑ Bienz 2007 ↓, s. 368–369.
- ↑ a b c Jabłoński 2002 ↓, s. 274–276.
- ↑ a b Payne 2017 ↓, s. 68–71.
- ↑ Elżbieta Samorek-Salamonowicz, Hanna Czekaj, Wojciech Kozdruń, Ptasia grypa – aspekty epidemiologiczne, „Medycyna Weterynaryjna”, 62 (5), 2006, s. 488–492.
- ↑ a b c Wojciech Kostowski, Leki przeciwwirusowe, [w:] Wojciech Kostowski, Zbigniew S. Herman (red.), Farmakologia. Podstawy farmakoterapii. Tom 2, wyd. III, Warszawa: Wydawnictwo Lekarskie PZWL, 2008, s. 250–251, ISBN 978-83-200-3726-5.
- ↑ a b Sylwia Gajewska-Mészáros, Leki przeciwwirusowe, [w:] Józef Mészáros, Sylwia Gajewska-Mészáros (red.), Podstawy farmakologii, wyd. III, Warszawa: Wydawnictwo Lekarskie PZWL, 1999, s. 221, ISBN 83-200-2323-8.
- ↑ Józefiak 2019 ↓, s. 257.
- ↑ a b c Ernst Mutschler i inni, Farmakologia i toksykologia, Wrocław: Medpharm, 2009, s. 904, 907, ISBN 978-83-60466-81-0.
- ↑ Józefiak 2019 ↓, s. 259.
- ↑ a b Sara Imanpour i inni, Factors associated with antibiotic prescriptions for the viral origin diseases in office-based practices, 2006–2012, „JRSM Open”, 8 (8), 2017, DOI: 10.1177/2054270417717668.
- ↑ Józefiak 2019 ↓, s. 267.
- ↑ Józefiak 2019 ↓, s. 274.
- ↑ Jabłoński 2002 ↓, s. 270–272.
- ↑ Jabłoński 2002 ↓, s. 277–279.
- ↑ Jabłoński 2002 ↓, s. 280.
- ↑ Dimmock 2007 ↓, s. 66–67.
- ↑ Dimmock 2007 ↓, s. 67–68.
- ↑ Józefiak 2019 ↓, s. 246.
- ↑ Novel Coronavirus (2019-nCoV). World Health Organization. [dostęp 2020-02-24].
- ↑ Kryczyński 2010 ↓, s. 122–123.
- ↑ Kryczyński 2010 ↓, s. 123–125.
- ↑ Kryczyński 2010 ↓, s. 129.
- ↑ Kryczyński 2010 ↓, s. 134–135.
- ↑ a b c Collier i Oxford 2001 ↓, s. 47–48.
- ↑ a b c d Prescott 2002 ↓, s. 364.
- ↑ Collier i Oxford 2001 ↓, s. 52–53.
- ↑ Bienz 2007 ↓, s. 373–379.
- ↑ a b Carter i Saunders 2007 ↓, s. 298.
- ↑ Josiane E Garneau, Sylvain Moineau, Bacteriophages of lactic acid bacteria and their impact on milk fermentations, „Microbial Cell Factories”, 10, 2011, s. 1–10, DOI: 10.1186/1475-2859-10-S1-S20.
- ↑ Mariángeles Briggiler Marcó i inni, Inactivation of Dairy Bacteriophages by Thermal and Chemical Treatments, „Viruses”, 11 (480), 2019, s. 1–28, DOI: 10.3390/v11050480.
- ↑ a b c d Carter i Saunders 2007 ↓, s. 298–299.
- ↑ Matthieu Legendre i inni, In-depth study of Mollivirus sibericum, a new 30,000-y-old giant virus infecting Acanthamoeba, „Proceedings of the National Academy of Sciences of the United States of America”, 2015, s. 1–9, DOI: 10.1073/pnas.1510795112.
- ↑ Carter i Saunders 2007 ↓, s. 301–302.
- ↑ a b Prescott 2002 ↓, s. 378.
- ↑ a b c d e f Józefiak 2019 ↓, s. 223–224.
- ↑ Payne 2017 ↓, s. 81.
- ↑ a b Pommerville 2018 ↓, s. 495.
- ↑ Curtis A. Suttle, Marine viruses – major players in the global ecosystem, „Nature Reviews Microbiology”, 5, 2007, s. 801–812, DOI: 10.1038/nrmicro1750.
- ↑ Ping Ouyang i inni, IL-10 encoded by viruses: a remarkable example of independent acquisition of a cellular gene by viruses and its subsequent evolution in the viral genome, „Journal of General Virology”, 95 (2), 2014, DOI: 10.1099/vir.0.058966-0.
- ↑ Ronnie Henry, Etymologia: Poliomyelitis, „Emerging Infectious Diseases”, 25 (8), 2019, s. 1611, DOI: 10.3201/eid2508.ET2508.
- ↑ a b c d e f g h Prescott 2002 ↓, s. 362–363.
- ↑ Amita Jain, Parul Jain, Essentials of Microbiology, Elsevier, 2019, s. 141, ISBN 978-81-312-5487-5.
- ↑ a b c d Cann 2005 ↓, s. 3–4.
- ↑ a b Robert J. Smutny, On the Presence of a Plural of the Latin Noun „Virus”, „ASM News”, 65, 1999, s. 388.
- ↑ Oxford Latin Dictionary, Oxford University Press, 1968, s. 2074.
- ↑ a b c d Cann 2005 ↓, s. 3–5.
- ↑ Dimmock 2007 ↓, s. 5.
- ↑ Schlegel 2005 ↓, s. 171.
- ↑ Flint 2015b ↓, s. 6.
- ↑ Jeffery K. Taubenberger, David M. Morens, 1918 Influenza: the Mother of All Pandemics, „Emerging Infectious Diseases”, 12 (1), 2006, s. 15–22, DOI: 10.3201/eid1201.050979.
- ↑ David R. Harper, Viruses: Biology, Applications, and Control, Garland Science, 2012, s. 3, ISBN 978-0-8153-4150-5.
- ↑ Flint 2015a ↓, s. 16.
- ↑ Erling Norrby, Nobel Prizes and the emerging virus concept, „Archives of Virology” (153), 2008, s. 1109–1123, DOI: 10.1007/s00705-008-0088-8.
- ↑ Flint 2015b ↓, s. 7.
- ↑ Flint 2015b ↓, s. 219.
- ↑ Roossinck 2016 ↓, s. 16–17.
- ↑ a b Flint 2015a ↓, s. 3–4.
- ↑ a b c Shannon E. Greene, Ann Reid, Viruses Throughout Life & Time: Friends, Foes, Change Agents, [w:] A Report on an American Academy of Microbiology Colloquium San Francisco [online], American Society for Microbiology, 2013 [dostęp 2021-01-15].
- ↑ a b c d Forest Rohwer, David Prangishvili, Debbie Lindell, Roles of viruses in the environment, „Environmental Microbiology”, 11 (11), 2009, s. 2771–2774, DOI: 10.1111/j.1462-2920.2009.02101.x.
- ↑ Curtis A. Suttle, Viruses in the sea, „Nature”, 437, 2005, s. 356–361, DOI: 10.1038/nature04160.
- ↑ a b Roossinck 2016 ↓, s. 245.
- ↑ Marilyn J. Roossinck, The good viruses: viral mutualistic symbioses, „Nature Reviews. Microbiology”, 9 (2), 2011, s. 99–108, DOI: 10.1038/nrmicro2491.
- ↑ Flint 2015a ↓, s. 4.
- ↑ a b Edward B. Chuong, The placenta goes viral: Retroviruses control gene expression in pregnancy, „PLoS Biology”, 16 (10), 2018, DOI: 10.1371/journal.pbio.3000028.
- ↑ a b c d Carter i Saunders 2007 ↓, s. 3–4.
- ↑ Carter i Saunders 2007 ↓, s. 230–231.
- ↑ Józefiak 2019 ↓, s. 277–282.
- ↑ Józefiak 2019 ↓, s. 283.
- ↑ Ricardo Ishak i inni, Infectious Agents As Markers of Human Migration toward the Amazon Region of Brazil, „Frontiers in Microbiology”, 8 (1663), 2017, s. 1–10, DOI: 10.3389/fmicb.2017.01663.
- ↑ VanMeter i Hubert 2016 ↓, s. 121.
Bibliografia edytuj
- K.A. Bienz, Wirusologia ogólna, [w:] Piotr B. Heczko, Agata Pietrzyk (red.), Mikrobiologia lekarska, wyd. I, Warszawa: Wydawnictwo Lekarskie PZWL, 2007, ISBN 978-83-200-3154-6.
- Alan J. Cann, Principles of Molecular Virology, wyd. IV, Elsevier, 2005, ISBN 0-12-088787-8.
- John Carter, Venetia Saunders, Virology. Principles and Applications, Wiley, 2007, ISBN 978-0-470-02386-0.
- Leslie Collier, John Oxford, Wirusologia, wyd. II, Warszawa: Wydawnictwo Lekarskie PZWL, 2001, ISBN 83-200-2600-8.
- Leslie Collier, John Oxford, Human Virology, wyd. III, Oxford University Press, 2006, ISBN 978-0-19-856660-1.
- N.J. Dimmock, A.J. Easton, K.N. Leppard, Introduction to Modern Virology, Blackwell Publishing, 2007, ISBN 978-1-4051-3645-7.
- Jane Flint i inni, Principles of Virology. Molecular Biology, wyd. IV, t. I, ASM Press, 2015, DOI: 10.1128/9781555818951, ISBN 978-1-55581-933-0.
- Jane Flint i inni, Principles of Virology. Pathogenesis and Control, wyd. IV, t. II, ASM Press, 2015, DOI: 10.1128/9781555818968, ISBN 978-1-55581-934-7.
- Anna Goździcka-Józefiak (red.), Wirusologia, wyd. I, Warszawa: Wydawnictwo Naukowe PWN, 2019, ISBN 978-83-01-20471-6.
- Roger Hull, Comparative Plant Virology, wyd. II, Academic Press, 2009, ISBN 978-0-12-374154-7.
- W. Irving, T. Boswell, D. Ala Aldeen, Mikrobiologia medyczna, Warszawa: Wydawnictwo Naukowe PWN, 2008, ISBN 978-83-01-15476-9.
- Leon Jabłoński, Epidemiologia zakażeń i chorób wirusowych, [w:] Leon Jabłoński, Irena Dorota Karwat (red.), Podstawy epidemiologii ogólnej, epidemiologia chorób zakaźnych, wyd. I, Lublin: Wydawnictwo Czelej, 2002, ISBN 83-88063-76-6.
- Mirosław Kańtoch, Wirusologia lekarska, wyd. I, Warszawa: Wydawnictwo Lekarskie PZWL, 1998, ISBN 83-200-2218-5.
- Selim Kryczyński, Wirusologia roślinna, Warszawa: Wydawnictwo Naukowe PWN, 2010, ISBN 978-83-01-16195-8.
- Jennifer Louten, Essential Human Virology, Elsevier, 2016, ISBN 978-0-12-800947-5.
- Susan Payne, Viruses: From Understanding to Investigation, Elsevier, 2017, ISBN 978-0-12-803109-4.
- Jeffrey C. Pommerville, Fundamentals of Microbiology, wyd. XI, Jones & Bartlett Learning, 2018, ISBN 978-1-284-10095-2.
- Lansing M. Prescott, Microbiology, wyd. V, The McGraw–Hill Companies, 2002, ISBN 0-07-282905-2.
- Marilyn J. Roossinck, Virus. An illustrated guide to 101 incredible microbes, Princeton University Press, 2016, ISBN 978-0-691-16696-4.
- Hans G. Schlegel, Mikrobiologia ogólna, wyd. II, Warszawa: Wydawnictwo Naukowe PWN, 2005, ISBN 83-01-13999-4.
- Karin C. VanMeter, Robert J. Hubert, Microbiology for the Healthcare Professional, wyd. II, Elsevier, 2016, ISBN 978-0-323-32092-4.
- Maria Lucyna Zaremba, Jerzy Borowski, Mikrobiologia lekarska, wyd. III, Warszawa: Wydawnictwo Lekarskie PZWL, 2001, ISBN 83-200-2485-4.